题目内容
15.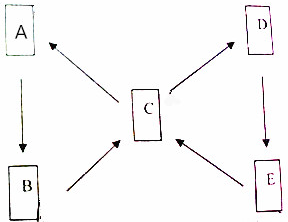 A、B、C、D、E都是含铜元素的物质,其中,A为单质,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,C为一种硫酸盐且为蓝色溶液,D和胃液中的酸含有一种相同的元素,E为蓝色沉淀,它们的转化关系如图所示,请你结合信息推断:
A、B、C、D、E都是含铜元素的物质,其中,A为单质,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,C为一种硫酸盐且为蓝色溶液,D和胃液中的酸含有一种相同的元素,E为蓝色沉淀,它们的转化关系如图所示,请你结合信息推断:(1)写出符合题意的物质的化学式:ACu,DCuCl2;
(2)按要求写出化学方程式:B→CCuO+H2SO4=CuSO4+H2O,E→CCu(OH)2+H2SO4=CuSO4+2H2O;
(3)D转化为E,可以选择烧碱(填该物质的俗称)和D反应来实现;
(4)这五种物质的转化中,没有涉及到的基本反应类型是分解反应.
分析 根据A、B、C、D、E都是含铜元素的物质,A为单质,所以A是铜,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,所以B是氧化铜,C为一种硫酸盐且为蓝色溶液,所以C是硫酸铜,D和胃液中的酸含有一种相同的元素,所以D是氯化铜,E为蓝色沉淀,会转化成硫酸铜,所以E是氢氧化铜,然后将推出的物质进行验证即可.
解答 解:(1)A、B、C、D、E都是含铜元素的物质,A为单质,所以A是铜,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,所以B是氧化铜,C为一种硫酸盐且为蓝色溶液,所以C是硫酸铜,D和胃液中的酸含有一种相同的元素,所以D是氯化铜,E为蓝色沉淀,会转化成硫酸铜,所以E是氢氧化铜,经过验证,推导正确,所以A是Cu,D是CuCl2;
(2)B→C的反应是氧化铜和硫酸反应生成硫酸铜和水,化学方程式为:CuO+H2SO4=CuSO4+H2O,
E→C的反应是氢氧化铜和硫酸反应生成硫酸铜和水,化学方程式为:Cu(OH)2+H2SO4=CuSO4+2H2O;
(3)D转化为E的反应是氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,可以选择烧碱和D反应来实现;
(4)氧化铜和硫酸的反应属于复分解反应,硫酸铜生成铜的反应属于置换反应,铜和氧气生成氧化铜的反应属于化合反应,所以没有涉及到的基本反应类型是分解反应.
故答案为:(1)Cu,CuCl2;
(2)CuO+H2SO4=CuSO4+H2O,
Cu(OH)2+H2SO4=CuSO4+2H2O;
(3)烧碱;
(4)分解反应.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
10.某化学兴趣小组的同学想探究一瓶在空气中放置一段时间的氢氧化钠溶液是否变质,通过讨论,共提出了四种方案:
A.用酸碱指示剂测定溶液的酸碱性 B.滴加稀盐酸
C.滴加氢氧化钠溶液 D.滴加氯化钡溶液
(1)写出氢氧化钠在空气中变质的化学方程式2NaOH+CO2═Na2CO3+H2O.
(2)小华同学首先否定了方案A,其理由是碳酸钠溶液显碱性.同学们对该瓶氢氧化钠溶液是否以及变质的程度进行了如探究.
探究活动一:检验该瓶氢氧化钠溶液是否变质
(3)同学们选用稀盐酸对待物质进行检验,请你实验报告填写完整.
探究二:测定该瓶氢氧化钠溶液中碳酸的质量分数
(4)同学们按如图所示的实验步骤进行实验:

①步骤②加入的氯化钡溶液必须足量,其目的是除去碳酸钠,防止影响对NaOH的检验,滴加一定量氯化钡溶液后,判断所加氯化钡溶液是否足量的具体操作;静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化钡已经过量(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是BaCO3(填化学式).
(6)利用沉淀物的质量计算溶液中碳酸钠的质量分数,若缺少步骤④的操作,所测定溶液中碳酸钠的质量分数将偏大(选填“偏小”、“偏大”或“没影响”).
A.用酸碱指示剂测定溶液的酸碱性 B.滴加稀盐酸
C.滴加氢氧化钠溶液 D.滴加氯化钡溶液
(1)写出氢氧化钠在空气中变质的化学方程式2NaOH+CO2═Na2CO3+H2O.
(2)小华同学首先否定了方案A,其理由是碳酸钠溶液显碱性.同学们对该瓶氢氧化钠溶液是否以及变质的程度进行了如探究.
探究活动一:检验该瓶氢氧化钠溶液是否变质
(3)同学们选用稀盐酸对待物质进行检验,请你实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样逐滴滴加稀盐酸 | 开始时无明显现象,过一段时间后有大量气泡产生 | 该瓶氢氧化钠溶液部分(填“全部”或“部分”)变质,滴加稀盐酸后发生反应的化学方程式:①aOH+HCl=NaCl+H2O、②Na2CO3+2HCl=2NaCl+CO2↑+H2O |
(4)同学们按如图所示的实验步骤进行实验:

①步骤②加入的氯化钡溶液必须足量,其目的是除去碳酸钠,防止影响对NaOH的检验,滴加一定量氯化钡溶液后,判断所加氯化钡溶液是否足量的具体操作;静置,取上层清液于试管中,向试管中滴加碳酸钠溶液,产生白色沉淀,氯化钡已经过量(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是BaCO3(填化学式).
(6)利用沉淀物的质量计算溶液中碳酸钠的质量分数,若缺少步骤④的操作,所测定溶液中碳酸钠的质量分数将偏大(选填“偏小”、“偏大”或“没影响”).
7.用酒精灯加热,被加热的试管(或其它器皿)部分应对位于( )
| A. | 火焰的内焰 | B. | 火焰的外焰 | C. | 火焰的焰心 | D. | 任何部位都可 |
4.化学科学的发展对人们的生活,人体健康有着重要的影响,同时材料是时代进步的重要标志,而能源被称为人类社会发展的三大支柱之一.下列某一主题的知识归纳,有错误的是( )
| A.化学与能源 | B.化学与健康 |
| 核反应发电-通过化学变化实现 维持人体生命活动所需要的能量-由化学能转化而来 利用风力、潮汐发电-通过化学变化实现 | 缺铁--会引发缺铁性贫血 重金属盐中毒-喝鲜牛奶、豆浆等解毒 常食用新鲜的蔬菜、水果-获得丰富的维生素C,预防坏血病 |
| C.化学与生活 | D.化学与材料 |
| 鉴别蛋白质与淀粉-用碘溶液来鉴别 鉴别纯棉织物与纯毛织物-用灼烧闻气味的方法来鉴别 鉴别硬水与软水-用肥皂水来鉴别 | 水泥、玻璃、陶瓷-都属于无机非金属材料 玻璃钢、钢筋混凝土-都属于复合材料 信息时代对社会有重大影响的材料-晶体硅材料、光导纤维 |
| A. | A | B. | B | C. | C | D. | D |

 如图所示,A~F是初中化学常见的物质.已知E是氧化物中相对分子质量最小的物质,C与D反应可产生气体.试回答下列问题:
如图所示,A~F是初中化学常见的物质.已知E是氧化物中相对分子质量最小的物质,C与D反应可产生气体.试回答下列问题: