题目内容
12.如图图1是KNO3的溶解度曲线,图2是某同学配制的20℃的溶液①,改变了一些条件,又得到溶液②、③、④.请回答:
(1)配制溶液①时,为了加快溶解,需要使用的玻璃仪器是玻璃棒.
(2)溶液③为饱和溶液(填“饱和”或“不饱和”).
(3)溶质质量分数相等的是B.
A.①②B.①④C.②③D.②④
(4)过滤④可得晶体的质量为78 g.
分析 根据题目信息和溶解度曲线可知:硝酸钾固体物质的溶解度,是随温度升高而增大的;配制溶液①时,为了加快溶解,需要使用的玻璃仪器是玻璃棒;溶液③为饱和溶液因为在该温度下100g水中溶解了110g硝酸钾;溶质质量分数相等的是①④;过滤④可得晶体的质量为=110g-32g=78g.
解答 解:(1)硝酸钾固体物质的溶解度,是随温度升高而增大的;配制溶液①时,为了加快溶解,需要使用的玻璃仪器是玻璃棒;故答案为:玻璃棒;
(2)溶液③为饱和溶液因为在该温度下100g水中溶解了110g硝酸钾,故答案为:饱和;
(3)溶质质量分数相等的是①④;故答案为:B
(4)过滤④可得晶体的质量为=110g-32g=78g,故答案为:78g;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
2.下列实验操作中正确的是( )
| A. | 加热试管中的液体,试管口不对着人 | |
| B. | 用过氧化氢制氧气时,用二氧化锰做催化剂且加热才行 | |
| C. | 将盛有高锰酸钾固体的试管竖直加热制氧气 | |
| D. | 量筒用来量取热溶液的体积 |
3.碳酸氢铵俗称“碳铵”,是常用的氮肥.碳酸氢铵受热易分解,生成两种氧化物和氨气.请你根据所学知识设计实验,证明下表中对两种氧化物的猜想:
(1)填下表空白.
(2)写出碳铵受热分解的化学方程式:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(3)由此实验你得到些什么启示?碳酸氢铵应该密闭存放在低温阴凉处.
(1)填下表空白.
| 猜想 | 实验操作 | 实验现象 | 结论 |
| 一种是水蒸气 | 取适量碳铵放在干燥的试管中,加热分解,用无水硫酸铜检验. | 无水硫酸铜变蓝 | 碳酸氢铵分解生成了水 |
| 一种是二氧化碳 | 将生成的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | 碳酸氢铵分解生成了二氧化碳 |
(3)由此实验你得到些什么启示?碳酸氢铵应该密闭存放在低温阴凉处.
20.下列是化学式H2O所表示的意义,其中错误的是( )
| A. | 表示水这种物质 | |
| B. | 表示1个水分子 | |
| C. | 表示水由氢元素和氧元素组成 | |
| D. | 表示1个水分子由2个氢元素和1个氧元素构成 |
10.实验室常用下列装置制取有关气体.
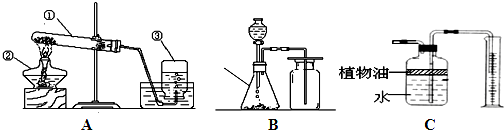
(1)用KMnO4固体来制取O2,应选用图中的A装置(填A或B).该发生装置还可以做我们学过的铜绿分解实验,用写出这个反应的文字表达式铜绿$\stackrel{加热}{→}$氧化铜+二氧化碳+水.
(2)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水,植物油上方原有的空气对实验的结果没有(填“有”或“没有”)明显影响.
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大.
加热
(4)氨气(NH3)的密度比空气的小,极易溶于水,实验室制取氨气的反应原理是:氢氧化钙(固)+氯化铵(固)$\frac{\underline{\;加热\;}}{\;}$氯化钙(固)+氨气+水.实验室制取氨气,若选择A装置,应该将此装置如何改动?排水法改为向下排空气法
(5)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的文字表达式:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气
(6)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
【问题】(1)MnO2和Fe2O3是上述反应中的催化剂剂.
(2)实验②,③中的H2O2的浓度(ω%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
【问题】(3)从上表中能得出哪些结论?催化剂相同时过氧化氢溶液浓度越大,反应速度越快;
(7)【提出问题】小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
【猜想】水泥块能作过氧化氢分解的催化剂.
【实验验证】
【结论】水泥块能加快过氧化氢的分解速率,故水泥起能作过氧化氢的催化剂.
【讨论与反思】小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究水泥块在反应前后质量是否改变.
【实验步骤】①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量④对比反应前后水泥块的质量.
【分析】如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究水泥块的化学性质在反应前后是否改变.

(1)用KMnO4固体来制取O2,应选用图中的A装置(填A或B).该发生装置还可以做我们学过的铜绿分解实验,用写出这个反应的文字表达式铜绿$\stackrel{加热}{→}$氧化铜+二氧化碳+水.
(2)C装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水,植物油上方原有的空气对实验的结果没有(填“有”或“没有”)明显影响.
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大.
加热
(4)氨气(NH3)的密度比空气的小,极易溶于水,实验室制取氨气的反应原理是:氢氧化钙(固)+氯化铵(固)$\frac{\underline{\;加热\;}}{\;}$氯化钙(固)+氨气+水.实验室制取氨气,若选择A装置,应该将此装置如何改动?排水法改为向下排空气法
(5)实验室里还可采用B图装置,通过用MnO2作催化剂分解过氧化氢(H202)的方法制取氧气.写出该反应的文字表达式:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气
(6)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H2O2溶液的试管中,加入a克MnO2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H2O2溶液的试管中,加入a克Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO2和a克Fe2O3.
【问题】(1)MnO2和Fe2O3是上述反应中的催化剂剂.
(2)实验②,③中的H2O2的浓度(ω%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
浓度 时间(min) 条件 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| a克MnO2 | 0.2 | 0.8 | 2.0 |
| a克Fe2O3 | 7.0 | 9.0 | 16.0 |
(7)【提出问题】小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
【猜想】水泥块能作过氧化氢分解的催化剂.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解 |
| 实验二 | 在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 | 木条复燃 | 水泥块能加快双氧水分解速率 |
【讨论与反思】小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究水泥块在反应前后质量是否改变.
【实验步骤】①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量④对比反应前后水泥块的质量.
【分析】如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究水泥块的化学性质在反应前后是否改变.
7.根据题意回答下列问题.

(1)写出图中有标号仪器的名称:①分液漏斗,②锥形瓶.
(2)用高锰酸钾制取氧气时,发生反应的符号表达式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是B(填序号),该反应的符号表达式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如表:(其他条件均相同)
请你分析表中数据并回答:MnO2的用量对反应速率有无影响,如果有,怎样影响?有影响,在一定范围内,随着二氧化锰质量的增加,反应速率越快
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:取相同质量的二氧化锰,分别用不同浓度的过氧化氢溶液,测定每次收集到500mL氧气时所用的时间
(4)A装置中试管口略向下倾斜的原因是防止试管口的冷凝水倒流,引起试管底部炸裂.
(5)已知NO气体难溶于水,相同条件下密度略大于空气,极易与氧气反应.实验室收集NO的装置是(填序号)E.
(6)采用E装置收集气体,如何判断收集满当瓶口有大量气泡冒出时.

(1)写出图中有标号仪器的名称:①分液漏斗,②锥形瓶.
(2)用高锰酸钾制取氧气时,发生反应的符号表达式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是B(填序号),该反应的符号表达式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如表:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰(MnO2)粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所有时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:取相同质量的二氧化锰,分别用不同浓度的过氧化氢溶液,测定每次收集到500mL氧气时所用的时间
(4)A装置中试管口略向下倾斜的原因是防止试管口的冷凝水倒流,引起试管底部炸裂.
(5)已知NO气体难溶于水,相同条件下密度略大于空气,极易与氧气反应.实验室收集NO的装置是(填序号)E.
(6)采用E装置收集气体,如何判断收集满当瓶口有大量气泡冒出时.
 某矿山的石灰石样品中含有二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).名师学校的同学们想测定该样品中碳酸钙的质量分数,他们采取了一块石灰石样品,将其敲碎后,称出6g放入烧杯内(烧杯质量为20g).然后加入50g的稀盐酸,用玻璃杯搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质总重量(m)的关系如图所示.试回答:
某矿山的石灰石样品中含有二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).名师学校的同学们想测定该样品中碳酸钙的质量分数,他们采取了一块石灰石样品,将其敲碎后,称出6g放入烧杯内(烧杯质量为20g).然后加入50g的稀盐酸,用玻璃杯搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质总重量(m)的关系如图所示.试回答: 医生给病人输液时,常用葡萄糖注射液.图为葡萄糖注射液的部分标签图,请根据图回答问题:
医生给病人输液时,常用葡萄糖注射液.图为葡萄糖注射液的部分标签图,请根据图回答问题: