题目内容
8.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
(1)用符号表示:带两个单位负电荷且质子数为8的离子O2-(写一种).AB2型化合物MgCl2、CO2(写两种).
(2)去年底重庆开县发生天然气“井喷”事件.喷出的气体中有一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,请用符号和数字表示:3个A2B分子3H2S.
(3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是质子数依次增大,请预测质子数为20的元素在表中的位置②(填①、②、③).
(4)已知元素周期表中原子序数等于质子数.请从元素种类、质子数分析第二、第三周期的元素分布,有什么规律?由左到右第二、三周期元素都是质子数依次递增;元素种类由金属元素到非金属元素到稀有气体元素过渡的相同的变化规律.
分析 (1)根据质子数来确定元素,再利用“2-”标在元素符号的右上角来表示离子符号,利用AB2型化合物来分析A、B的化合价,确定元素的位置来分析解答;
(2)根据有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸可确定是氢硫酸,再利用元素符号及数字来表示3个分子;
(3)根据周期表判断原子的排列规律,然后利用原子序数及最外层电子数来预测元素在周期表中的位置,利用最外层电子数进一步判断离子的结构示意图;
(4)根据周期表判断元素的排列规律.
解答 解:(1)因质子数为8单核原子为氧原子,则利用“2-”标在元素符号的右上角来表示氧离子符号,即带两个单位负电荷且质子数为8的离子为O2-,
由AB2型化合物,则A为+2价,B为-1价,则可以从周期表的第二列和倒数第二列来找合适的元素,如Mg与Cl可形成MgCl2,若A为+4价,B为-2价,则可以从周期表中的倒数第五列和倒数第三列来找合适的元素,如C与O可形成CO2,故答案为:O2-;MgCl2;CO2;
(2)由一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,则该酸为氢硫酸,其化学式为H2S,化学式可表示1个分子,则在化学式的前面加数字“3”可表示3个分子,故答案为:3H2S;
(3)由周期表可知,在每一横行原子按照质子数由小到大的顺序来排列,即元素从左向右的排列规律是质子数依次增大,质子数为20的元素有4个电子层,最外层电子数为2,则在周期表中的第4个横行和第2个竖列的位置,即在②处,该原子变为离子时失去最外层2个电子而满足最外层8电子的稳定结构,即离子的结构中最外层电子数为8,则元素离子的结构示意图为甲图,故答案为:质子数依次增大,②;
(4)由左到右第二、三周期元素都是质子数依次递增;元素种类由金属元素到非金属元素到稀有气体元素过渡的相同的变化规律.
点评 本题考查学生对元素周期表的认识和应用,将理论与元素、化合物知识结合在一起,难度较大,且考查的知识点较多,学生应熟悉原子的结构及常见物质的性质来解答.

 阅读快车系列答案
阅读快车系列答案| A. | 没有说明用量的,药品可以取任意量 | |
| B. | 使用试管夹时,试管夹要从试管口向下套夹在试管中上部 | |
| C. | 用剩的药品要放回原瓶,不要随意丢弃,以免浪费 | |
| D. | 向试管中滴加液体时,滴管尖嘴不能伸入试管内 |
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加足量稀盐酸,并不断振荡. | 有气泡冒出 | 该反应的方程式为 2HCl+Na2CO3═2NaCl+H2O+CO2↑,由此可知该氢氧化钠溶液一定变质了. |
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】氯化钙溶液呈中性.
【实验探究2】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有白色沉淀 | 说明原溶液中一定有碳酸钠. 写出该反应的化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色 | 说明原溶液中一定有氢氧化钠. |
【反思与评价】(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:CO2+2NaOH=Na2CO3+H2O.
(2)在上述【实验探究2】中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案不可行(填“可行”或“不可行”).原因是因为氢氧化钙与碳酸钠反应会生成氢氧化钠,这样无法确定(2)步骤的实验结论,得不出氢氧化钠部分变质的结论.
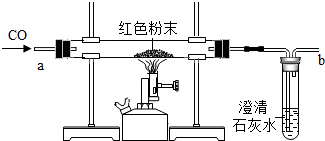 在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.(1)【提出问题】假设l:红色粉末是铜粉;
假设2:红色粉末是氧化铁粉;
假设3:红色粉末是铜粉和氧化铁粉的混合物.
(2)【设计实验方案】同学们对实验作了如下设想和分析:取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如图所示).
请你完成下表:
| 实验中可能出现的现象 | 结论 |
| 假设1成立 | |
| 假设2成立 | |
| 假设3成立 |
(4)【反思与评价】
①实验过程中,硬质玻璃管内发生反应的化学方程式是3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②实验时通入一氧化碳片刻后再加热的原因是防止加热一氧化碳和空气的混合气体时发生爆炸.
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是在b处用酒精灯点燃,或用塑料袋(气球)收集.
 已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如下图所示.
已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如下图所示. 电蚊拍一般使用2.4V镍氢电池,工作时电网瞬间产生1850V直流高压电(电流小于10mA,对人畜无害),能将蚊虫吸入电网电毙.如图是一款电蚊拍,请根据图示回答下列问题:
电蚊拍一般使用2.4V镍氢电池,工作时电网瞬间产生1850V直流高压电(电流小于10mA,对人畜无害),能将蚊虫吸入电网电毙.如图是一款电蚊拍,请根据图示回答下列问题: