题目内容
18.牙膏中的摩擦剂碳酸钙可以用石灰石来制备.甲同学设计了一种实验方案:
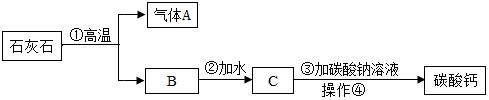
(1)步骤②的化学方程式CaO+H2O═Ca(OH)2.
该反应是放热(填“放热”或“吸热”)反应.
(2)操作④中需要用到的玻璃仪器,除了玻璃棒、烧杯之外,还需漏斗.
乙同学设计了另一种实验方案:
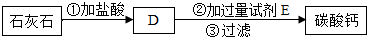
(3)写出D中加试剂E的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl.判断试剂E已加过量的方法是:取少量上层清液于试管中,滴加稀盐酸,若有气泡产生,则Na2CO3已加过量.
(4)请你写出乙同学实验方案的一个优点:操作简单,节约能源.
分析 (1)根据步骤②是氧化钙和水反应,进行分析解答.
(2)操作④是过滤进行分析;
(3)根据氯化钙的化学性质结合复分解反应进行分析.
(4)乙同学的方案不需要加热,据此进行分析解答.
解答 解:(1)步骤②即生成的氧化钙与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2;该反应放出大量的热.
(2)操作④是过滤,需要用到的玻璃仪器,除了玻璃棒、烧杯之外,还需漏斗.
(3)D是氯化钙,加入试剂E后生产碳酸钙,因此试剂E可以是碳酸钠,反应化学方程式是Na2CO3+CaCl2=CaCO3↓+2NaCl.判断碳酸钠溶液已加过量的方法是取少量上层清液于试管中,滴加稀盐酸,若有气泡产生,则Na2CO3已加过量.
(4)乙同学的方案,与甲同学的方案相比,不需要高温加热,直接和稀盐酸反应,操作简单,且节约能源.
故填:(1)CaO+H2O═Ca(OH)2;放热;(2)漏斗;(3)Na2CO3+CaCl2=CaCO3↓+2NaCl;取少量上层清液于试管中,滴加稀盐酸,若有气泡产生,则Na2CO3已加过量;(4)操作简单,节约能源.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析解答.

练习册系列答案
相关题目
13.如图表示治理汽车尾气所涉及反应的微观过程.下列说法不正确的是( )

| A. | 图中单质的化学式为N2 | B. | 该反应使有毒气体转化为无毒气体 | ||
| C. | 该反应属于置换反应 | D. | 反应前后原子个数不变 |
3.下列化学方程式中正确的是( )
| A. | 2Fe+6HCl═2FeCl3+3H2↑ | B. | H2O2$\frac{\underline{\;催化剂\;}}{\;}$H2↑+O2↑ | ||
| C. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO | D. | CO+CuO $\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu |
2.实验室常用的制取气体的发生装置如图所示:
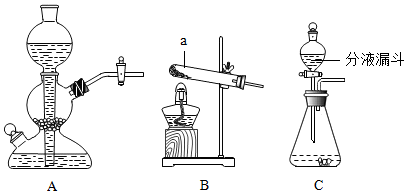
(1)搭建B装置时,酒精灯应在固定仪器a之前(选填(“前”或“后”)放置,实验结束时应先移出水中的导管,再熄灭酒精灯
(2)在实验室制取二氧化碳的研究中,进行了如表实验:
Ⅰ.上述实验中反应的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑.
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验乙与甲对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应快慢的因素是固体反应物的颗粒大小(或反应物的接触面积)
(3)Ⅰ.研究发现酸浓度越大,产生气体的速度越快;浓盐酸有挥发性.与甲比较,对丁分析正确的是ab(选填编号)
a.反应更为剧烈 b.最终反应装置中剩余物质的质量更小
c.产生二氧化碳的质量更大 d.粉末状大理石利用率更高
Ⅱ.如表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳的产生.请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因.

(1)搭建B装置时,酒精灯应在固定仪器a之前(选填(“前”或“后”)放置,实验结束时应先移出水中的导管,再熄灭酒精灯
(2)在实验室制取二氧化碳的研究中,进行了如表实验:
| 试验编号药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验乙与甲对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应快慢的因素是固体反应物的颗粒大小(或反应物的接触面积)
(3)Ⅰ.研究发现酸浓度越大,产生气体的速度越快;浓盐酸有挥发性.与甲比较,对丁分析正确的是ab(选填编号)
a.反应更为剧烈 b.最终反应装置中剩余物质的质量更小
c.产生二氧化碳的质量更大 d.粉末状大理石利用率更高
Ⅱ.如表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳的产生.请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因.
| 目的 | 原料 | 发生装置 | 气体较平稳产生的最主要的一个原因 |
| 制取二氧化碳 | 块状大理石稀盐酸 | A | 反应物的接触面积较小 |
| 制取氧气 | 粉末状二氧化锰 3%的过氧化氢溶液 | C | 通过分液漏斗控制液体滴加速度 |
19.下列反应属于中和反应的是( )
| A. | NaOH+HNO3═NaNO3+H2O | B. | CuO+H2SO4═CuSO4+H2O | ||
| C. | Fe+2HCl═FeCl2+H2↑ | D. | CO2+2NaOH═Na2CO3+H2O |
 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答: 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: