题目内容
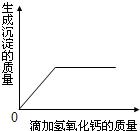
 将15gCaCl2溶液逐滴加入到20g Na2CO3溶液中可发生如下反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,测得生成沉淀的质量与加入CaCl2溶液的质量存在如图所示关系.
将15gCaCl2溶液逐滴加入到20g Na2CO3溶液中可发生如下反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,测得生成沉淀的质量与加入CaCl2溶液的质量存在如图所示关系.(1)当滴入10gCaCl2溶液时,生成沉淀的质量为
(2)原CaCl2溶液中溶质的质量分数是多少?(要求写出计算过程,下同)
(3)将反应后所得混合物过滤,弃去滤渣,再将滤液蒸干,可得到固体的质量是多少?
分析:(1)根据图中坐标系中所给的数据分析可以得出沉淀的质量;
(2)根据生成的沉淀质量可以求算出10g氯化钙溶液中含有的氯化钙的质量,进而求算出氯化钙溶液中溶质的质量分数;
(3)根据题意可以知道反应后的溶液为氯化钠和氯化钙的混合溶液,所以可以根据化学方程式求出氯化钠的质量,根据(2)的解答求算出剩余溶液中氯化钙的质量.
(2)根据生成的沉淀质量可以求算出10g氯化钙溶液中含有的氯化钙的质量,进而求算出氯化钙溶液中溶质的质量分数;
(3)根据题意可以知道反应后的溶液为氯化钠和氯化钙的混合溶液,所以可以根据化学方程式求出氯化钠的质量,根据(2)的解答求算出剩余溶液中氯化钙的质量.
解答:解:(1)从图象中可以得出生成沉淀的质量为2g;
(2)从图中可以看出,滴加CaCl2溶液至l0g时,沉淀便不再增加,即反应中消耗氯化钙溶液的质量为10g,
设10gCaCl2溶液中含CaCl2的质量为x,反应生成NaCl的质量为y.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 2g y
=
=
解得:x=2.22g,y=2.34g;
原CaCl2溶液中溶质的质量分数为:22.2%
(3)从图中可以看出,滴加CaCl2溶液至l0g时,沉淀便不再增加,由此可知Na2CO3全部参加反应,而CaCl2有剩余.即反应后的溶液为氯化钠和氯化钙的混合溶液,剩余CaCl2的质量为:15g×22.2%-2.22g=1.11g,蒸发滤液可得固体的质量为:1.11g+2.3 4 g=3.45g
答:(2)原CaCl2溶液中溶质的质量分数是22.2%;
(3)将反应后所得混合物过滤,弃去滤渣,再将滤液蒸干,可得到固体的质量是3.45g.
故答案为:(1)2;
(2)22.2%;
(3)3.45g.
(2)从图中可以看出,滴加CaCl2溶液至l0g时,沉淀便不再增加,即反应中消耗氯化钙溶液的质量为10g,
设10gCaCl2溶液中含CaCl2的质量为x,反应生成NaCl的质量为y.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 2g y
| 111 |
| x |
| 100 |
| 2g |
| 117 |
| y |
解得:x=2.22g,y=2.34g;
原CaCl2溶液中溶质的质量分数为:22.2%
(3)从图中可以看出,滴加CaCl2溶液至l0g时,沉淀便不再增加,由此可知Na2CO3全部参加反应,而CaCl2有剩余.即反应后的溶液为氯化钠和氯化钙的混合溶液,剩余CaCl2的质量为:15g×22.2%-2.22g=1.11g,蒸发滤液可得固体的质量为:1.11g+2.3 4 g=3.45g
答:(2)原CaCl2溶液中溶质的质量分数是22.2%;
(3)将反应后所得混合物过滤,弃去滤渣,再将滤液蒸干,可得到固体的质量是3.45g.
故答案为:(1)2;
(2)22.2%;
(3)3.45g.
点评:本题主要考查化学方程式的计算,解此类问题的关键就是写正确物质反应的化学方程式.根据化学方程式找出已知量和未知量的之间关系,然后,根据这个关系列比例式求解.

练习册系列答案
相关题目
 将15gCaCl2溶液逐滴加入到20g Na2CO3溶液中可发生如下反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,测得生成沉淀的质量与加入CaCl2溶液的质量存在如图所示关系.
将15gCaCl2溶液逐滴加入到20g Na2CO3溶液中可发生如下反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,测得生成沉淀的质量与加入CaCl2溶液的质量存在如图所示关系.