题目内容
29、现有HCl、NaCl、NaOH、Na2CO3等溶液.若进行下列实验,请判断可能的溶液组合.
(1)两两组合进行实验:
①组合后无明显现象,但发生反应的组合是
写出该反应的化学方程式为
②组合后有明显现象,该现象是
反应的化学方程式为
(2)任意组合进行实验:
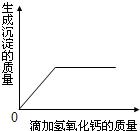
若将氢氧化钙溶液逐滴滴入组合溶液中,产生的沉淀与加入的氢氧化钙有如图所示的关系,则溶液的组合可能是
(1)两两组合进行实验:
①组合后无明显现象,但发生反应的组合是
NaOH、HCl
;写出该反应的化学方程式为
NaOH+HCl═NaCl+H2O
.②组合后有明显现象,该现象是
有气泡产生
.反应的化学方程式为
Na2CO3+2HCl═2NaCl+H2O+CO2↑
.(2)任意组合进行实验:
若将氢氧化钙溶液逐滴滴入组合溶液中,产生的沉淀与加入的氢氧化钙有如图所示的关系,则溶液的组合可能是
①Na2CO3和NaOH
②Na2CO3和NaCl
③Na2CO3、NaOH和NaCl
.②Na2CO3和NaCl
③Na2CO3、NaOH和NaCl

分析:根据物质的种类可以选择组合的数量(HCl和NaOH、混合后无明显现象,因在溶液中反应生成水),根据反应物和生成物及其质量守恒定律可以正确书写化学方程式,本题应考虑复分解反应相互交换成分生成另外两种化合物的特点;根据实验现象:产生的沉淀(氢氧化钙溶液只与以上物质中的碳酸钠反应生成沉淀)可以选择物质的组合方面的情况.
解答:解:①HCl和NaOH、混合后无明显现象,因在溶液中反应生成水,看不到现象,但发生了化学反应,有关的化学方程式为:HCl+NaOH=NaCl+H2O;
故答案为:NaOH、HCl;NaOH+HCl═NaCl+H2O
②溶液中的反应现象是生成气体、沉淀或溶液变色;根据以上物质HCl和Na2CO3反应生成氯化钠、水和二氧化碳,生成的二氧化碳逸出,有气泡产生.
故答案为:有气泡产生、Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)氢氧化钙溶液只与以上物质中的碳酸钠反应生成沉淀,故其溶液中一定含有碳酸钠;因含有碳酸钠则组合溶液中不含有与碳酸钠能反应的氯化氢;则组合溶液应是Na2CO3与NaCl、NaOH之间的组合;
故答案为:①Na2CO3和NaOH、②Na2CO3和NaCl、③Na2CO3、NaOH和NaCl
故答案为:NaOH、HCl;NaOH+HCl═NaCl+H2O
②溶液中的反应现象是生成气体、沉淀或溶液变色;根据以上物质HCl和Na2CO3反应生成氯化钠、水和二氧化碳,生成的二氧化碳逸出,有气泡产生.
故答案为:有气泡产生、Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)氢氧化钙溶液只与以上物质中的碳酸钠反应生成沉淀,故其溶液中一定含有碳酸钠;因含有碳酸钠则组合溶液中不含有与碳酸钠能反应的氯化氢;则组合溶液应是Na2CO3与NaCl、NaOH之间的组合;
故答案为:①Na2CO3和NaOH、②Na2CO3和NaCl、③Na2CO3、NaOH和NaCl
点评:解答本题的关键是要掌握各种物质的性质,只有掌握了物质的性质才能确定物质之间能否反应及其反应的实验现象等方面的内容.

练习册系列答案
相关题目

 现有HCl、NaCl、NaOH、Na2CO3等溶液.若进行下列实验,请判断可能的溶液组合.
现有HCl、NaCl、NaOH、Na2CO3等溶液.若进行下列实验,请判断可能的溶液组合.
