题目内容
7.氢氧化钠是一种重要的碱,同学们对它进行了如下探究.(1)探究 I:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
小明同学取少量反应后的溶液于一支试管中,并滴加几滴无色酚酞试液,振荡.观察到酚酞试液不变色.他得出结论是“恰好完全中和”.
小华同学取少量反应后的溶液于一支试管中,并滴加稀硝酸和硝酸银溶液.观察到有白色沉淀产生.她得出结论是“盐酸过量,没有完全中和”.
小亮认为他们都是错误的.他认为小明错误的原因是如果反应后的溶液显酸性,酚酞试液也不变色.
小亮又用化学方程式表示了小华错误的原因,该化学方程式为NaCl+AgNO3═AgCl↓+NaNO3.
小亮认为正确的方法是要通过测定溶液的酸碱度来判断,在测定酸碱度时用的实验用品有pH试纸、标准比色卡、玻璃棒和白瓷板等.
(2)探究 II:一瓶久置的氢氧化钠固体的成分是什么?
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加足量的氯化钡溶液,观察到有白色沉淀产生. 发生的化学方程式为BaCl2+Na2CO3═2NaCl+BaCO3↓
步骤二:取步骤一试管中少量上层清液,滴加无色酚酞,观察到酚酞变红色.该久置的氢氧化钠固体的成分是氢氧化钠和碳酸钠(写出名称).
(3)探究 III:将一瓶纯净的氢氧化钠固体久置,久置后样品中氢氧化钠的含量是多少?
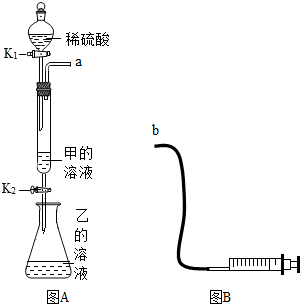
方法一:取mg样品配成图A所示的甲溶液,关闭K1,打开K2,把甲溶液滴加到乙溶液中,直到不再产生沉淀为止.再将锥形瓶中的混合物过滤、洗涤、干燥,称出其质量即可计算出氢氧化钠的含量.如果乙是10%的氯化钙溶液,则溶液质量最好是A.
A.15mg B.30mg C.8mg
方法二:将图A和图B的a、b处连接起来,检查装置的气密性后,取ng样品配成图A所示的甲溶液,将稀硫酸倒入分液漏斗中,关闭K2,打开K13打开分液漏斗的玻璃活塞,再将稀硫酸滴入甲溶液中直到不再产生气泡为止,根据注射器中的体积读数就能计算出氢氧化钠的含量.则注射器的体积最好是B(信息:常温下,该反应产生气体的密度为1.8g/L).
A.100nmL B.250nmL C.200nmL.
分析 根据已有的氢氧化钠的性质进行分析及解答,氢氧化钠能与盐酸反应生成氯化钠和水,氯化钠能与硝酸银反应生成氯化银沉淀,酚酞在酸性和中性溶液中不变色,据此解答.
解答 解:(1)氢氧化钠与盐酸反应,若是盐酸剩余,酚酞试液也不变色,故填:方案一中如果反应后的溶液显酸性,酚酞试液也不变色;
氯化钠能与硝酸银反应产生氯化银沉淀和硝酸钠,故填:NaCl+AgNO3=AgCl↓+NaNO3;
在测定酸碱度时用的实验用品有pH试纸、标准比色卡、玻璃棒和白瓷板等.故填:pH试纸;
(2)步骤一:久置的氢氧化钠变质会生成碳酸钠,氯化钡能与碳酸钠反应生成碳酸钡沉淀和氯化钠,发生的化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
步骤二:除去碳酸钠以后,取上层清液加入酚酞试液变红,说明含有氢氧化钠,根据实验可以看出,久置的氢氧化钠固体中含有碳酸钠和氢氧化钠,故填:氢氧化钠和碳酸钠.
(3)假设mg全部是碳酸钠,设氯化钙的质量为x
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106
x mg
$\frac{111}{106}=\frac{x}{mg}$
x=$\frac{111}{106}mg$
故氯化钙溶液的质量为:$\frac{111}{106}mg$÷10%≈10.5mg,故填:A;
假设ng样品全部是碳酸钠,则生成二氧化碳的质量设为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
ng y
$\frac{106}{44}=\frac{ng}{y}$ y≈0.42ng
二氧化碳的体积为:0.42ng÷1.8g/L≈0.233L=233nmL,故注射器的体积为250nmL合适,故填:B.
点评 本题考查的是常见的物质成分的判断,完成此题,可以依据已有的物质的性质进行.

 阅读快车系列答案
阅读快车系列答案| A. |  分离KNO3和NaCl | B. |  H2还原CuO | ||
| C. |  测定空气中O2的含量 | D. |  收集CO2气体 |
 某研究性学习小组的同学前往当地的大理石进行调査,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测.采用了以下的办法:取16g这种大理石,逐滴滴加稀盐酸,剩余固体的质量与所加盐酸的质量关系如图示(杂质不溶于水,不与盐酸反应).
某研究性学习小组的同学前往当地的大理石进行调査,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测.采用了以下的办法:取16g这种大理石,逐滴滴加稀盐酸,剩余固体的质量与所加盐酸的质量关系如图示(杂质不溶于水,不与盐酸反应).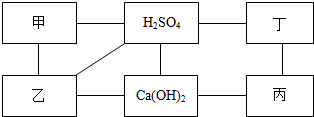 如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.
如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.
 商代的司母戊方鼎标志着我国在3000多年前青器铸造已达到一个较高的水平.西汉时期,我国首开“湿法炼铜”之先河,西汉刘安所著的《淮南万毕术》中已有“曾青得铁化为铜”的记载.试回答:
商代的司母戊方鼎标志着我国在3000多年前青器铸造已达到一个较高的水平.西汉时期,我国首开“湿法炼铜”之先河,西汉刘安所著的《淮南万毕术》中已有“曾青得铁化为铜”的记载.试回答:
 如图标出的是灭火器的组成物质,请回答下列问题.
如图标出的是灭火器的组成物质,请回答下列问题.