题目内容
天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的稀硫酸,此时天平平衡,将等质量的MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错误的是( )
|
| A. | 若天平不平衡,指针一定偏向加Na2CO3的一边 |
|
| B. | 若天平平衡,两烧杯中的酸一定完全反应 |
|
| C. | 若反应后Na2CO3有剩余,天平一定平衡 |
|
| D. | 若天平不平衡,两种碳酸盐一定都没有剩余 |
考点:
盐的化学性质;根据化学反应方程式的计算.
专题:
常见的盐 化学肥料.
分析:
在天平的两个托盘上,放上质量相等的两个烧杯,在烧杯中分别加入等质量等浓度的硫酸,此时天平处于平衡状态,然后分别向两只烧杯中加入等质量的Na2CO3和MgCO3粉末,反应物放在一起不反应的状态时,天平是平衡的,指针的偏转主要是看生成二氧化碳的多少,因此解题时判断二氧化碳多少则成为解题的关键所在,所以可计算相同质量的Na2CO3和MgCO3完全反应放出二氧化碳质量的大小,天平的指针会偏向质量大(下沉)的一方.
解答:
解:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,根据化学方程式,利用关系式法计算加入碳酸钠,溶液质量的变化.
Na2CO3~CO2↑ 溶液质量增加(△m)
106 44 62
106g 62g
MgCO3+H2SO4=MgSO4+H2O+CO2↑,根据化学方程式,利用关系式法计算加入碳酸镁,溶液质量的变化.
MgCO3~CO2↑ 溶液质量增加(△m)
84 44 40
106g m

m=50.5g,所以加入碳酸钠一端溶液质量增重大,故放Na2CO3的一端托盘下沉,
由此可知:
A、若天平不平衡,指针一定偏向加Na2CO3的一边,故对;
B、酸完全反应,生成二氧化碳的质量相同,天平平衡,故对;
C、若反应后Na2CO3有剩余,天平一定平衡,故错;
D、若天平不平衡,两种碳酸盐一定都没有剩余,故对.
答案:C
点评:
本题是比较抽象的根据化学方程式的计算,解本题的关键是分析左右两盘实际质量的变化,题目难度中等.

将10g碳酸钙固体高温煅烧一段时间,冷却后投入足量稀盐酸中完全反应,有关结论错误的是( )
|
| A. | 共生成0.1mol氯化钙 |
|
| B. | 燃烧越充分则消耗的盐酸越少 |
|
| C. | 共生成0.1mol二氧化碳 |
|
| D. | 燃烧后固体中氧元素的质量分数减小 |
物质的用途与性质密切相关,下列说法正确的是( )
|
| A. | 小苏打能作发酵粉,是因为小苏打能与面粉反应 |
|
| B. | 洗洁精能洗去碗筷上的油污,是因为油污能溶于洗洁精 |
|
| C. | 浓硫酸可用于作干燥剂,是因为浓硫酸具有吸水性 |
|
| D. | 液氧可用于火箭发射,是因为氧气具有可燃性 |
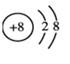 (2)3个铝离子的化学符号是______________。
(2)3个铝离子的化学符号是______________。
