题目内容
14.下表是KNO3和NaCl在不同温度时的溶解度:| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60[ | 70 | 80 | 100 | |
| 溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 246 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.8 | |
(2)20℃时,将20g NaCl投入50g水中,所得溶液是饱和(填“饱和”或“不饱和”)溶液.在该温度下,不能(填“能”或“不能”)用稀释36%的NaCl溶液的方法来配制10%的NaCl溶液.
(3)当KNO3固体中混有少量NaCl固体时,提纯KNO3的方法是降温结晶法.
(4)80℃时,等质量的KNO3和NaCl分别配成饱和溶液,然后降温至20℃,.下列说法正确的是A、B(填序号).
A、20℃时,得到的都是饱和溶液
B、20℃时,KNO3溶液的浓度小于NaCl溶液浓度
C、剩余溶液中溶剂质量:KNO3>NaCl.
分析 (1)观察图表,纵向对比对氯化钠和硝酸钾在相同温度下的溶解度,再横向对比氯化钠和硝酸钾在不同温度下的溶解度,然后得出结论.
(2)根据20℃时,氯化钠的溶解度来分析;
(3)溶解度受温度变化影响较大的物质中混入溶解度受温度影响较小的物质,可用降温结晶的方法提纯;
(4)根据两种物质的溶解度及其受温度的影响情况来分析.
解答 解:(1)观察图表可知,0℃时,氯化钠的溶解度是35.7,硝酸钾的溶解度是13.3g,100℃时,氯化钠的溶解度是39.8g,硝酸钾的溶解度是246g,据此可知氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大.故答案为:氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大;(合理即可)
(2)由表格信息可知,20℃时,氯化钠的溶解度为36.0g,即在该温度下,100g水中最多溶解36.0g氯化钠就达到饱和状态,若在该温度下的50g水中,最多能溶解18.0g氯化钠就达到饱和状态;该温度下的氯化钠饱和溶液中溶质的质量分数为:$\frac{36g}{36g+100g}×100%$≈26.5%,得不到36%的氯化钠溶液;故填:饱和;不能;
(3)KNO3的溶解度受度变化影响较大,NaCl的溶解度受温度影响较小,所以若KNO3中混有少量NaCl,可利用降温结晶的方法提纯KNO3;故填:降温结晶法;
(4)A.两种物质的溶解度都是最温度的降低而减小,所以80℃时的饱和溶液,降温至20℃时,仍为饱和状态,故正确;
B.由表格信息可知,20℃时,KNO3的溶解度小于NaCl的溶解度,故该温度的饱和溶液中,氯化钠饱和溶液的浓度大,故正确;
C.此过程中,溶剂的量不变,因为80℃时,硝酸钾的溶解度远大于氯化钠的溶解度,所以该温度下等质量的硝酸钾和氯化钠配制成饱和溶液,氯化钠需要的溶剂多,故错误.故填:A、B.
点评 本题考查了据溶解度的意义和饱和溶液中溶质的质量分数分析解答问题,难度不大.

| 主食 | 米饭 |
| 副食 | 红烧肉、糖醋鱼、排骨汤 |
| 饮料 | 加钙牛奶 |
(2)下列关于钙的说法中,正确的是②.(填①或②序号)
①为了防止缺钙,青少年应大量吃钙片 ②幼儿或青少年缺钙可能患佝偻病
(3)小明妈妈在厨房用到的下列物品中,所使用的主要材料属于合成材料的是③(填①~③序号).①铁锅 ②棉布围裙 ③合成橡胶手套.
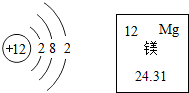 如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )
如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )| A. | 镁原子的质子数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁位于周期表中第3周期,第2主族 | |
| D. | 在化学反应中,镁原子容易失去2个电子 |
| A. | 样品中一定含有Na2CO3 | B. | 样品中一定含有KNO3 | ||
| C. | 样品中一定含有Ba(NO3)2 | D. | 样品中一定含有Na2CO3和KNO3 |