题目内容
8.某同学欲测定骨灰中碳酸钙的含量,称取69g试样于烧杯中,加入29.2g稀盐酸恰好完全反应,充分反应后,称得混合物的总质量为93.8g(忽略二氧化碳的溶解对质量的影响).请计算:(1)反应过程中产生的二氧化碳质量为4.4g.
(2)该骨灰试样中碳酸钙的质量分数14.5%.
分析 根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,结合质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量,进而计算出骨灰样中碳酸钙的质量分数.
解答 解:(1)根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,反应过程中产生的二氧化碳质量为69g+29.2g-93.8g=4.4g;
(2)设骨灰试样中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
x=10g
骨灰试样中碳酸钙的质量分数为$\frac{10g}{69g}$×100%=14.5%.
故答案为:(1)4.4;
(2)骨灰试样中碳酸钙的质量分数为14.5%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列玻璃仪器能直接加热的是( )
| A. | 试管 | B. | 烧杯 | C. | 烧瓶 | D. | 量筒 |
3.用酒精灯加热试管里的液体时,下列操作不正确的是( )
| A. | 试管外壁应该干燥,试管里的液体不应超过试管容积的$\frac{1}{3}$ | |
| B. | 用试管夹夹持试管时,应由试管底部套上、取下 | |
| C. | 加热时,应先使试管底部均匀受热,然后用酒精灯的内焰固定加热 | |
| D. | 试管口不能对着自己和他人 |
17.以下对O2、CO2、MnO2三种物质组成的说法中,正确的是( )
| A. | 都含有氧分子 | B. | 都含有两个氧原子 | ||
| C. | 都含有氧元素 | D. | 都含有氧气 |

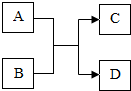 A、B、C、D都是初中化学种常见的物质,A、C组成元素相同的两种气体氧化物,D为紫红色金属单质.它们之间的相互转化关系如图(图中反应条件已略去).则:
A、B、C、D都是初中化学种常见的物质,A、C组成元素相同的两种气体氧化物,D为紫红色金属单质.它们之间的相互转化关系如图(图中反应条件已略去).则: