题目内容
【题目】学习了MnO2可催化过氧化氢溶液分解制取氧气后,某同学猜想Al2O3 能否起到类似MnO2的催化作用呢?于是进行了以下探究。
[猜想与假设]
猜想1:Al2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
猜想2:Al2O3参与反应并产生O2,反应前后质量和化学性质发生了改变;
猜想3:Al2O3是反应的催化剂,反应前后_____。
[实验设计]用天平称量Al2O3 0.2 g,取5 mL 5%的过氧化氢溶液于试管中,进行如下实验:
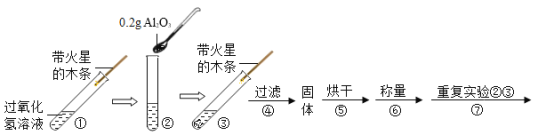
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出带火星的木条复燃 | 称量Al2O3的质量仍为0.2 g | 溶液中有大量气泡放出_____, | 猜想3成立 |
(2)步骤①③的目的是_____。
(3)写出Al2O3 催化过氧化氢溶液分解产生氧气的文字表达式:_____。
[继续探究]氧化铝是否比二氧化锰的催化效果更好?
小雨以生成等体积的氧气为标准,设计下列三组实验(其他可能影响实验的因素均忽略):
实验序号 | 5%过氧化氢溶液体积 | 催化剂种类及质量 | 待测数据 |
① | 5 mL | ||
② | 5 mL | 0.5 g Al2O3 | |
③ | 5 mL | 0.5gMnO2 |
(4)上述实验测量的“待测数据”是_____。
(5)若测得实验②的数据比实验③的数据大
[实验反思]
(6)影响过氧化氢溶液分解产生氧气快慢的因素还可能有:_____(写两种)。
(7)请设计实验验证你的其中一种猜想:_____。
【答案】质量和化学性质不变 带火星的木条复燃 探究氧化铝是否能加快过氧化氢的分解速率 过氧化氢![]() 水+氧气 收集等量氧气所需时间 MnO2 反应物的浓度、温度 在相同温度下,取不同浓度的过氧化氢溶液分别加入等质量的二氧化锰粉末,观察哪个生成气泡的速度更快
水+氧气 收集等量氧气所需时间 MnO2 反应物的浓度、温度 在相同温度下,取不同浓度的过氧化氢溶液分别加入等质量的二氧化锰粉末,观察哪个生成气泡的速度更快
【解析】
[猜想与假设]:Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变;故填:质量和化学性质不变;
[实验设计](1)氧化铝对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有大量气泡产生,带火星的木条复燃;故填:带火星的木条复燃;
(2)步骤①③的目的是探究氧化铝是否能加快过氧化氢的分解速率;故填:探究氧化铝是否能加快过氧化氢的分解速率;
(3)Al2O3催化过氧化氢溶液分解产生氧气和水;故填:过氧化氢![]() 水+氧气;
水+氧气;
(4)本题的实验目的证明氧化铝能加快过氧化氢的分解,所以“待测数据”是收集等量氧气所需时间。故填:收集等量氧气所需时间;
(5)若测得实验②的数据比实验③的数据大,说明MnO2对过氧化氢溶液分解的催化效果更好。故填:MnO2;
[实验反思](6)影响化学反应快慢的因素很多,如反应物的浓度、温度、催化剂的颗粒大小、接触面积等,故填:反应物的浓度、温度;
(7)探究反应物的浓度对反应速率的影响可设计如下实验:在相同温度下,取不同浓度的过氧化氢溶液分别加入等质量的二氧化锰粉末,观察哪个生成气泡的速度更快;故填:在相同温度下,取不同浓度的过氧化氢溶液分别加入等质量的二氧化锰粉末,观察哪个生成气泡的速度更快。










