题目内容
6. 如图是“XXX”钙片商品标签图.
如图是“XXX”钙片商品标签图.根据标签信息完成下列题.
(1)主要成分碳酸钙的相对分子质量为100;
(2)每片中至少含钙元素的质量为0.496g.
(3)小蓉同学为测其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g.称量烧杯中剩余物质质量为47.8g(不含烧杯质量,假定钙片其它成分不与盐酸反应.)
我来求出:①生成二氧化碳的质量.
②稀盐酸中溶质的质量分数.
③通过计算判断标签上钙片中碳酸钙的含量是否属实.
分析 (1)根据碳酸钙的化学式,利用相对分子质量等于各元素相对原子质量的和即可求得碳酸钙的相对分子质量;
(2)钙元素都在碳酸钙中了,用碳酸钙的质量×钙元素在碳酸钙中的质量分数,求出钙元素的质量.
(3)根据物质质量守恒,计算出生成的二氧化碳的质量,再根据化学方程式,得出各物质之间的质量比,列出比例式,即可求出反应掉HCl的质量,再根据溶质质量分数公式,即可求得稀盐酸中溶质的质量分数;
根据方程式的还可以计算出4片钙片中碳酸钙的质量,进而计算出一片钙片中碳酸钙的质量,再与标签做比较即可.
解答 解:(1)碳酸钙的化学式为:CaCO3,故碳酸钙的相对分子质量为:40+12+16×3=100;
碳酸钙(CaCO3)中钙元素的质量分数为:$\frac{40}{40+12+16×3}$×100%=40%,
则每片中至少含钙元素的质量为1.24g×40%=0.496g.
故答案为:100;0.496.
(2)解:①根据质量守恒定律可知,生成CO2的质量为:40g+4×2.5g-47.8g=2.2g
②设参加反应的CaCO3和HCl的质量分别为x,y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 2.2g
$\frac{100}{x}=\frac{73}{y}=\frac{44}{2.2g}$
解得x=5g;y=3.65g
则稀盐酸中溶质的质量分数为:$\frac{3.65g}{40g}$×100%=9.13%.
③每片含CaCO3的质量为:$\frac{5g}{4}$=1.25g>1.24g,故钙片中碳酸钙的含量标注准确.
答:生成二氧化碳的质量是2.2g,稀盐酸中溶质的质量分数为9.13%,通过计算含量标注属实.
点评 本题主要考查学生运用化学式以及化学方程式进行进行计算的能力.解决本题的关键是计算生成二氧化碳的质量.

【提出猜想】针对疑问,小明同学作出如下猜想:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
小华同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的是猜想四.
【实验探究】同学们对剩余的猜想进行了探究:
(1)取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,学习小组的同学设计了三套实验方案:
| 实验方案 | 取少量烧杯中溶液 | 实验现象 | 实验结论 |
| 方案一 | 加入Na2CO3溶液 | 有气泡产生 | 溶液中有H2SO4 |
| 方案二 | 滴加紫色石蕊溶液 | 溶液变红 | 溶液中有H2SO4 |
| 方案三 | 加入BaC12溶液 | 有白色沉淀生成 | 溶液中有H2SO4 |
【实验反思】写出方案一的化学方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
三个方案中有一个方案是错误的,原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.

(1)甲实验中滴加稀盐酸后,可观察到的现象是溶液变无色,证明两者确实发生了反应.
(2)乙实验中反应的方程式CO2+2NaOH═Na2CO3+H2O.
(3)丙实验中试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此说明废液中含有碳酸钙,一定不含有盐酸.
【提出问题】废液中究竟含有哪些物质?
【交流讨论】
①一定含有的物质:碳酸钙、指示剂、水和氯化钠.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小方认为:只有碳酸钠
小丽认为:只有氢氧化钙
小云认为:是氢氧化钠和碳酸钠
小新认为:只有氢氧化钠
你认为还可能是:氢氧化钠和氢氧化钙.
【实验设计】小斌想用氯化钙溶液来验证小方的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | 小方的猜想正确. |
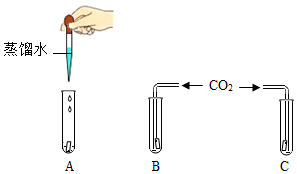 为证明CO2能与水反应,设计了如图所示的实验,图中A、B、C分别为用石蕊溶液染成的紫色干燥的滤纸,分析回答问题
为证明CO2能与水反应,设计了如图所示的实验,图中A、B、C分别为用石蕊溶液染成的紫色干燥的滤纸,分析回答问题
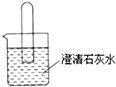 如图所示,将一个充满二氧化碳的试管倒立在盛有澄清石灰水的烧杯中,
如图所示,将一个充满二氧化碳的试管倒立在盛有澄清石灰水的烧杯中,