题目内容
13.用如图常用实验装置制取常见的气体,并进行相应性质实验.
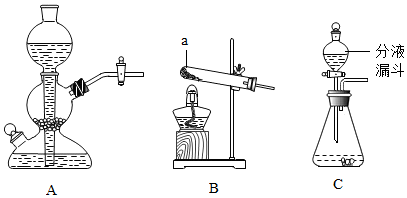
实验一:实验室中可用KClO3在MnO2催化下受热分解制取氧气,完全反应后对混合物进行
分离回收并进行相关性质实验,实验操作如图所示(MnO2难溶于水).
(1)写出图A中发生反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(2)图B操作的名称是溶解,图C操作中的一处明显错误是漏斗末端没有紧靠烧杯内壁,图D操作中,当看到有大量固体析出时停止加热.
实验二:
(1)若用图1装置制取二氧化碳气体,为了便于控制反应随时发生和停止,多孔隔板合适的
位置是a处(选填“a”、“b”或“c”),不适宜用作多孔隔板的材料是A.
A.铁 B.塑料C.铜片D.石墨
(2)用图1装置制取并收集两试管CO2气体,分别倒扣入图2盛有等体积NaOH溶液和水的 烧杯中,该组对比实验产生的现象说明CO2能与NaOH发生反应.
(3)为了进一步探究CO2与NaOH溶液的反应,取图2甲烧杯实验后的溶液于图3(A~D)四支试管中,分别滴入四种不同类别的试剂,B中加入的是足量稀HCl或稀HNO3或稀H2SO4.四种方案中不合理的是A(填字母),理由是NaOH、Na2CO3溶液均显碱性.
分析 图B操作的名称是溶解,图C操作中的一处明显错误是:漏斗末端没有紧靠烧杯内壁;图D操作中,当看到有大量固体析出时停止加热;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.用图1装置制取并收集两试管CO2气体,分别倒扣入图2盛有等体积NaOH溶液和水的 烧杯中,该组对比实验产生的现象说明:CO2能与NaOH发生反应;图3(A~D)四支试管中,分别滴入四种不同类别的试剂,B中加入的是酸,四种方案中不合理的是酚酞,理由是NaOH、Na2CO3溶液均显碱性.
解答 解:实验一:
(1)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;故答案为:2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)图B操作的名称是溶解,图C操作中的一处明显错误是:漏斗末端没有紧靠烧杯内壁;图D操作中,当看到有大量固体析出时停止加热,利用余温蒸发;故答案为:溶解;漏斗末端没有紧靠烧杯内壁;有大量固体析出;
实验二:
(1)若用图1装置制取二氧化碳气体,为了便于控制反应随时发生和停止,多孔隔板合适的位置是a处,不适宜用作多孔隔板的材料是铁,因为铁与盐酸反应;故答案为:a;A;
(2)用图1装置制取并收集两试管CO2气体,分别倒扣入图2盛有等体积NaOH溶液和水的 烧杯中,该组对比实验产生的现象说明:CO2能与NaOH发生反应;故答案为:CO2能与NaOH发生反应;
(3)图3(A~D)四支试管中,分别滴入四种不同类别的试剂,B中加入的是酸,四种方案中不合理的是酚酞,理由是NaOH、Na2CO3溶液均显碱性;故答案为:足量稀HCl或稀HNO3或稀H2SO4;A;NaOH、Na2CO3溶液均显碱性;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、过滤、蒸发、和实验探究等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


| A. | ①和④两种粒子的化学性质相似 | B. | ②和③表示的粒子均为离子 | ||
| C. | ③和④属于同种元素的不同粒子 | D. | ③表示的粒子的符号为Mg+2 |
| 26-A | 26-B |
| (1)钠原子转化为钠离子, 其核外电子数变小(填“变大”或“变小”). (2)常温下,氯化钠饱和溶液中,氯化钠与水的质量比为9:25 . (已知:常温下,氯化钠的溶解度为36g) | (1)构成氯化钠的微粒是Na+和Cl-(填微粒符号). (2)口罩使用过程中,氯化钠溶液中溶质的质量分数改变(填“改变”或“不变”) |
①仪器a的名称是试管;搭建B装置时,酒精灯应在固定仪器a之前(选填“前”或“后”)放置.
②实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③在实验室制取二氧化碳的研究中,进行了如下实验:
| 甲 | 乙 | 丙 | 丁 | |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是大理石的状态.
Ⅳ.研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是ad(选填编号)
a.反应更为剧烈
b.最终剩余溶液的质量更小
c.产生二氧化碳的质量更大
d.粉末状大理石利用率更高
④表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳的产生.请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因.
| 目的 | 原料 | 发生装置 | 气体较平稳产生的最主要的一个原因 |
| 制取二氧化碳 | 块状大理石稀盐酸 | A | 固体药品的状态和溶液的浓度有关 |
| 制取氧气 | 粉末状二氧化锰3%的过氧化氢溶液 | C | 二氧化锰起催化作用 |
(1)如表是KNO3在水中的溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
②60℃时,30g KNO3饱和溶液中溶质与溶剂的质量比为11:10.
(2)水中的溶氧量大小对水生生物至关重要.
①夏季为鱼池水补养,常用水泵将池水喷到空气中落下,其原理是B.(填序号)
A、增大氧气溶解度 B、增大水与空气的接触面积 C.升高水温
②下列大致图象中,不能反映氧气在水中溶解度规律的是B.(填序号)

| A. | 粉尘爆炸 | B. | 品红扩散 | C. | 石蜡熔化 | D. | 空气液化 |


