��Ŀ����
12��ijʵ��С��Ϊ̽����Ļ�ѧ���ʣ��ɼס�����ͬѧ��Ʋ��������ͼ��ʾ��ʵ�飮
��1����ͬѧʵ�����������Ļ�ѧ����ʽΪCa��OH��2+2HCl=CaCl2+2H2O��
���������ϡ�CaCl2��NaCl����Һ�����ԣ�Na2CO3��Һ�ʼ��ᡱ�����
��ʵ��̽��һ��ȷ���ס���ͬѧ����ʵ���������Һ�е����ʣ�
��2��ȡ��������Һ����������ʯ����Һ����Һ�Ժ�ɫ����������Һ��һ�����е�������CaCl2��HCl��д��ѧʽ����
��2��ȡ��������Һ�����������̪��Һ����Һ�Ժ�ɫ����������Һ��һ�����е�������NaCl��Na2CO3��д��ѧʽ����
��ʵ��̽������
��4���ס���ͬѧ������ʵ��������Һ����ͬһ��Һ���У��۲쵽��Һ���в����������ݣ������ְ�ɫ�������ɣ��ð�ɫ������CaCO3��д��ѧʽ����
�����۽�������ͬѧ��������������ϸ�������ȡ�������ˣ�������Һ�к�����Щ�����أ��������۴��һ����Ϊ��һ������NaCl�����ܺ���CaCl2�������Na2CO3�е㲿�����ʣ�
��ʵ��̽������ȡ������Һ���Թ��У��μӹ�����ϡ���ᣬ�ɹ۲쵽�������ݲ�����
�������ܽ����Һ�к��е��������Ȼ��ƺ�Na2CO3���ѧʽ����
���� ��1�����ݼ�ͬѧ��ʵ���ʵ��������
��2�����ݼ�ͬѧ��ʵ���ʵ�������Լ�ʯ����Һ�����ʽ��
��3��������ͬѧ��ʵ���ʵ�������Լ���̪��Һ�����ʽ��
��4������ʵ���ʵ�������Լ�̼���ơ��Ȼ��Ƶ����ʽ��з�����
��� �⣺��1����ͬѧʵ��������������ϡ����ķ�Ӧ����ѧ����ʽΪCa��OH��2+2HCl=CaCl2+2H2O��Na2CO3��Һ�Լ��ԣ�
��2��ȡ��������Һ����������ʯ����Һ����Һ�Ժ�ɫ��˵����Һ�����ԣ����Լ�������Һ��һ�����е�����CaCl2��HCl��
��3��ȡ��������Һ�����������̪��Һ����Һ�Ժ�ɫ��˵����Һ�Լ��ԣ�������������Һ��һ�����е�����NaCl��Na2CO3��
��4���ס���ͬѧ������ʵ��������Һ����ͬһ��Һ���У������Ļ�ѧ��Ӧ��Na2CO3+2HCl=2NaCl+H2O+CO2����Na2CO3+CaCl2=CaCO3��+2NaCl������ɫ������CaCO3��ȡ������Һ���Թ��У��μӹ�����ϡ���ᣬ�ɹ۲쵽�д������ݲ�����˵����Һ��һ����̼���ƣ�
�ʴ�Ϊ��
��1��Ca��OH��2+2HCl=CaCl2+2H2O���
��2��CaCl2��HCl��
��3��NaCl��Na2CO3��
��4��CaCO3�� Na2CO3��
���� ������������ͻ�Ƶ㣺һ�Ǹ��ݸ��ֽⷴӦ�������ж�����Щ�����ڷ�����Ӧ�������漰���йػ�ѧʽ�ļ��㣮

| A�� | ��0 | B�� | ��5.6 | C�� | =7 | D�� | ��7 |
��1���õ�ʯ��ȡ��Ȳ�Ļ�ѧ����ʽΪCaC2+2H2O�TCa��OH��2+C2H2������Ȳ��������ȼ�գ������ŵ������仯����Ϊ���⡢���ȣ�������Ȳ���������������Ӽ��и������
��2����ʯ��ȡ��Ȳ������Ļҽ��������Ʊ�KClO3���壮�������£�
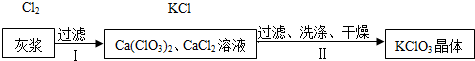
�������йع��˵�˵����ȷ����AD������ĸ����
A���ڻ�ѧʵ���й����Ƿ�������ij��÷���
B��ʹ�õIJ���������������©�����ձ���������
C����������ĩ��Ҫ�����б���ڵ�����ֽ��һ��
D���������е�Һ��ʼ��Ҫ������ֽ�ı�Ե
�ڳ������й����ʵ��ܽ�����±���ʾ��
| ���� | Ca��ClO3��2 | CaCl2 | KClO3 | KCl |
| �ܽ��/g | 209.0 | 74.5 | 7.3 | 34.2 |
�ۢ�������������ĸҺ��KClO3�ı��ͣ�����͡������͡�����Һ��д��ĸҺ���������ʵĻ�ѧʽKClO3��CaCl2��KCl��Ca��ClO3��2��
| A�� | 2Fe+3H2SO4�TFe2��SO4��3+H2�� | B�� | NaCl+KNO3�TNaNO3+KCl | ||
| C�� | C+O2$\frac{\underline{\;��ȼ\;}}{\;}$CO2 | D�� | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2��+O2�� |
| A�� | ����ˮpH��7.0 | B�� | �������ȪˮpH��6.8��7.8 | ||
| C�� | ij̼������pH��5.5��6.5 | D�� | �״�pH��3.8 |




 �ҹ�������Ⱦ����Ҫ��Դ������������ʹ�û�ʯȼ�ϡ�ȼú�ȣ�SO2����Ҫ������Ⱦ��֮һ����ʯ�ҽ�����SO2ת��Ϊʯ����һ�ֹ�ҵ����������ķ�����ͼ��
�ҹ�������Ⱦ����Ҫ��Դ������������ʹ�û�ʯȼ�ϡ�ȼú�ȣ�SO2����Ҫ������Ⱦ��֮һ����ʯ�ҽ�����SO2ת��Ϊʯ����һ�ֹ�ҵ����������ķ�����ͼ��