题目内容
7.电石(主要成分是CaC2)是制取乙炔(C2H2)的重要原料.(1)用电石制取乙炔的化学方程式为CaC2+2H2O═Ca(OH)2+C2H2↑.乙炔在氧气中燃烧,伴随着的能量变化表现为发光、放热,所以乙炔可用于照明、焊接及切割金属.
(2)电石制取乙炔后产生的灰浆可用来制备KClO3晶体.流程如下:
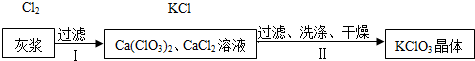
①下列有关过滤的说法正确的是AD(填字母).
A.在化学实验中过滤是分离混合物的常用方法
B.使用的玻璃仪器包括长颈漏斗、烧杯、玻璃棒
C.玻璃棒的末端要轻轻地斜靠在单层滤纸的一边
D.过滤器中的液面始终要低于滤纸的边缘
②常温下有关物质的溶解度如下表所示:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
③Ⅱ中析出晶体后的母液是KClO3的饱和(填“饱和”或“不饱和”)溶液,写出母液中所有溶质的化学式KClO3、CaCl2、KCl、Ca(ClO3)2.
分析 (1)根据质量守恒定律以及化学反应中的能量变化来分析;
(2)①根据过滤操作的原理、所需仪器以及注意事项来分析;
②根据图中反应流程,判断找出能与氯化钾反应生成氯酸钾的物质;根据图中所给信息中氯酸钾的溶解度进行分析解答;
③根据饱和溶液是不能再溶解某种溶质的溶液结合反应流程进行分析.
解答 解:(1)反应前有:Ca、2C,反应后有:Ca、2C、4H、2O,所以空格处应为2H2O;乙炔燃烧过程中,化学能转化为了光能与热能;2H2O;发光、放热;
(2)①A.过滤是用来分离难溶性固体与液体的常用方法,故正确;
B.过滤需要普通漏斗而不是长颈漏斗,故错误;
C.过滤操作中,玻璃棒的下端要紧靠在三层滤纸一侧,故错误;
D.过滤器内的液面要低于滤纸的边缘,故正确;
故填:AD;
②由图中反应流程氯化钾加入到氯化钙和氯酸钙混合物中发生反应,根据复分解反应发生的条件,氯化钙与氯化钾不反应,故氯化钾只能与氯酸钙反应生成氯酸钾;由题中物质在常温下的溶解度表中数据发现氯酸钾的溶解度较小,故生成氯酸钾由于常温下氯酸钾溶解度较小,所以过量的氯酸钾会结晶析出;故填:Ca(ClO3)2;
③通过分析可知,Ⅱ中析出晶体后的母液是KClO3的饱和溶液,最后得到的母液中含有KClO3、没有参与反应的CaCl2、生成的KCl以及Ca(ClO3)2.
故填:饱和;KClO3、CaCl2、KCl、Ca(ClO3)2
点评 此题综合考查物质的相互转化和制备,掌握质量守恒定律和正确书写化学方程式的方法是解题的关键.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
11.按如图装置实验,不能达到对应目的是( )
| A. |  收集H2 | B. |  O2验满 | ||
| C. |  配制20%的Ca(OH)2溶液 | D. |  盛放NaOH溶液 |
12.下列饮品中,属于溶液的是( )
| A. | 牛奶 | B. | 白酒 | C. | 豆浆 | D. | 咖啡 |
2.KOH溶液中含有H2O、K+、OH-、能使无色酚酞试液变成红色.某化学兴趣小组想探究KOH溶液使无色酚酞试液变成红色的原因.
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红.
猜想2:KOH溶液中的K+使无色酚酞试液变红.
猜想3:KOH溶液中的OH-(填化学式)使无色酚酞试液变红.
【实验探究】
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学理由是酚酞试液本身含有水分子.
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是溶液变为红色;
②KOH固体应密封保存,原因是2KOH+CO2═K2CO3+H2O(用化学方程式表示).
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红.
猜想2:KOH溶液中的K+使无色酚酞试液变红.
猜想3:KOH溶液中的OH-(填化学式)使无色酚酞试液变红.
【实验探究】
| 实验操作 | 实验现象 | 结论 |
| ①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液 | 试管内溶液不变色 | 猜想1不成立 |
| ②用试管取少量KCl溶液,滴入1-2滴无色酚酞试液 | 试管内溶液不变色 | 猜想2不成立 |
| ③用试管取少量氢氧化钾溶液,滴入1-2滴无色酚酞试液 | 试管内溶液变红 | 猜想3成立 |
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是溶液变为红色;
②KOH固体应密封保存,原因是2KOH+CO2═K2CO3+H2O(用化学方程式表示).
19.X元素原子的最外层有6个电子,Y元素的原子最外层有2个电子,X、Y元素化合形成的离子化合物的化学式为( )
| A. | YX | B. | Y2X | C. | YX2 | D. | XY |
17.下列有关CO2和CO的叙述,正确的是( )
| A. | CO2、CO都不能供给呼吸,都可以充入食品袋防止微生物繁殖从而延长保质期 | |
| B. | 二者的组成元素相同而化学性质不同的原因是原子的排列方式不同 | |
| C. | 当CO2混有少量CO时,可以在适量的氧气中燃烧CO,从而除去CO | |
| D. | CO2可用于制作碳酸饮料、作制冷剂,而CO可用于冶炼金属 |

