题目内容
7.某同学想确定工业样品碳酸钠中氯化钠的含量(假设除氯化钠外不含其他杂质),按流程进行了如下实验: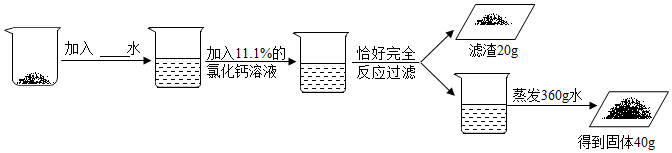
(1)加入氯化钙溶液后发生反应的化学方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓;
(2)求解原固体中发生反应的物质的(x)的比例式为:$\frac{106}{x}$=$\frac{100}{20g}$;
(3)原固体中碳酸钠和氯化钠的质量最简整数比为:106:83;
(4)加入水的质量是:182.2g;
(5)用此碳酸钠样品和Ca(OH)2反应制氢氧化钠80kg,需样品的质量为189kg.
分析 (1)根据氯化钙和碳酸钠反应生成好碳酸钙沉淀和氯化钠进行分析;
(2)根据化学方程式和生成沉淀的质量进行计算;
(3)根据化学方程式计算参加反应的碳酸钠的质量和样品质量及性能计算;
(4)根据蒸发水的质量和氯化钙溶液中水的质量进行计算;
(5)根据化学方程式和样品中碳酸钠的质量分数进行计算.
解答 解:(1)氯化钙和碳酸钠反应生成好碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓;
(2)设原固体中发生反应的物质的质量为x,生成氯化钠的质量为y,参加反应的氯化钙的质量为z
Na2CO3+CaCl2=2NaCl+CaCO3↓;
106 111 117 100
x z y 20g
$\frac{106}{x}$=$\frac{100}{20g}$=$\frac{117}{y}$=$\frac{111}{z}$
x=21.2g
y=23.4g
z=22.2g
(3)原固体中碳酸钠和氯化钠的质量最简整数比为21.2g:(40g-23.4g)=106:83;
(4)加入水的质量是360g-($\frac{22.2g}{11.1%}$-22.2g)=182.2g;
(5)设需样品的质量为m
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
106 80
m×$\frac{106}{106+83}$ 80kg
$\frac{106}{m×\frac{106}{106+83}}$=$\frac{80}{80kg}$
m=189kg.
故答案为:(1)Na2CO3+CaCl2=2NaCl+CaCO3↓;
(2)$\frac{106}{x}$=$\frac{100}{20g}$;
(3)106:83;
(4)182.2g;
(5)189kg.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. |  加热液体 | B. |  测定溶液pH | C. |  稀释浓硫酸 | D. |  过滤 |
| 选项 | A | B | C | D |
| 需区分的物质 | 软水和蒸馏水 | 氨气和二氧化碳 | 食盐水和纯碱溶液 | 聚乙烯和聚氯乙烯 |
| 方案一 | 加肥皂水搅拌 | 闻气味 | 滴加酚酞溶液 | 点燃闻气味 |
| 方案二 | 观察颜色 | 观察颜色 | 滴加食醋 | 加热,看是否熔化 |
| A. | A | B. | B | C. | C | D. | D |
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 | 实验现象 | 结论 |
| 先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液.并不断振荡,同时测定混合液的pH. | pH逐渐变大, 最后pH≥7 | 稀盐酸与氢氧化钠 溶液能发生反应 |
(2)设计实验,探究稀盐酸与氢氧化钠溶液的反应是否放热
提供的实验仪器与药品:10%的盐酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.(请填写实验步骤、实验现象)
| 实验步骤 | 实验现象 | 结论 |
| 稀盐酸与氢氧化钠 溶液反应放热 |
第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液 | 若生成蓝色沉淀 | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀盐酸与氢氧化钠溶液恰好完全反应 |
| A. | 在钢铁表面镀铬能防止钢铁生锈 | |
| B. | 浓盐酸露置于空气中质量会增大 | |
| C. | 棉纤维在空气燃烧时产生烧焦羽毛的气味 | |
| D. | 二氧化碳是造成酸雨的主要物质 |
 硒对人体有防癌、抗癌作用,如图1是硒元素在元素周期表中的部分信息,图2是硒元素的结构示意图,下列说法错误的是( )
硒对人体有防癌、抗癌作用,如图1是硒元素在元素周期表中的部分信息,图2是硒元素的结构示意图,下列说法错误的是( )| A. | 硒是人体必需的微量元素 | B. | 图2表示阴离子 | ||
| C. | 硒原子中子数是34 | D. | 硒是非金属元素 |



