题目内容
11.摩尔盐(硫酸亚铁铵晶体)具有重要作用,图为用处理过的废铁屑(主要成分为铁,同时含一定量的氧化铁)制取摩尔盐的过程示意图.回答下列问题;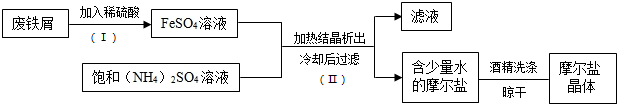
(1)根据上述过程判断,摩尔盐难(填“易”或“难”)溶解于酒精.
(2)小明向老师请教:步骤(Ⅰ)产物中含铁物质为何没有硫酸铁?老师指出,步骤(Ⅰ)中,除铁、氧化铁分别与硫酸反应外,还发生另一个反应.于是,小明进行了如下实验:
实验1:取适量铁粉加入足量硫酸,得到浅绿色溶液;
实验2:取适量氧化铁粉末加入足量硫酸,得到黄色溶液;
实验3:取适量实验2 所得溶液,加入足量铁粉,振荡,静置后得到浅绿色溶液.
请用对应反应的化学方程式回答下列问题:
①小明判断步骤(Ⅰ)应有硫酸铁的理由是废铁中含有氧化铁,它能与硫酸反应生成硫酸铁.
②实验结果表明,步骤(Ⅰ)产物无硫酸铁的原因是铁能与硫酸铁反应生成硫酸亚铁.
(3)步骤(Ⅱ)所得滤液中含有未反应的FeSO4、(NH4)2SO4,生产时可采用如右流程回收利用.已知,固体X与稀硫酸之间发生了中和反应,请写出滤液与足量的试剂Y混合时发生反应的化学方程式2NaOH+FeSO4=Fe(OH)2↓+Na2SO4;2NaOH+(NH4)2SO4=Na2SO4+2H2O+2NH3↑.

分析 (1)能用酒精洗涤摩尔盐,说明摩尔盐不溶于酒精;
(2)氧化铁与稀硫酸反应生成硫酸铁和水;硫酸铁能与铁反应;
(3)根据反应过程进行分析判断.
解答 解:(1)根据步骤③可知,用酒精可以洗去摩尔盐表面的水,然后晾干,说明摩尔盐不溶于酒精;故填:难;
(2)①因为废铁中含有氧化铁,它能与稀硫酸反应生成硫酸铁和水,故填:废铁中含有氧化铁,它能与硫酸反应生成硫酸铁;
②由实验可知,铁能与硫酸铁反应生成硫酸亚铁;故填:铁能与硫酸铁反应生成硫酸亚铁;
(3)X能与硫酸发生中和反应生成硫酸亚铁,所以X是氢氧化亚铁;由此可知,滤液与足量的试剂Y混合时发生反应是:氢氧化钠与硫酸亚铁发生的反应,还能与硫酸铵反应.故填:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4;2NaOH+(NH4)2SO4=Na2SO4+2H2O+2NH3↑.
点评 本题看上去是一道新信息题,但题目考查的知识点都是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
1.小明同学对超市一种新产品-“污渍爆炸盐”产生浓厚兴趣,该产品的主要成分是过氧碳酸钠(Na2CO4)在实验室,小明将污渍爆炸盐放入热水中,发现立即产生大量气泡,能使带火星的木条复燃.小明进一步将等浓度的过氧化氢溶液放入相同温度的热水中,发现此时的过氧化氢分解速率明显小于污渍爆炸盐的分解速率.
【提出问题】促进过氧化氢分解的微粒是什么?
【查阅资料】
1.过氧碳酸钠(Na2CO4)与水反应生成碳酸盐和过氧化氢;
2.可溶性盐在水溶液中都是以金属离子(或NH4+)和酸根离子的形式存在;
【作出猜想】猜想一:促进过氧化氢分解的微粒可能是水分子
猜想二:促进过氧化氢分解的微粒可能是Na+
猜想三:促进过氧化氢分解的微粒可能是CO32-
小松同学指出,不可能是水分子促进了过氧化氢的分解.你赞成(填“赞成”或“不赞成”),你的理由是过氧化氢溶液中就存在水分子,没有加快反应速率.
【设计实验】
【交流讨论】小松同学提出,上述实验方案不严谨,还需补充一个实验,请你帮他写出实验方案验证反应前后碳酸钠的化学性质和质量是否发生改变.
【提出问题】促进过氧化氢分解的微粒是什么?
【查阅资料】
1.过氧碳酸钠(Na2CO4)与水反应生成碳酸盐和过氧化氢;
2.可溶性盐在水溶液中都是以金属离子(或NH4+)和酸根离子的形式存在;
【作出猜想】猜想一:促进过氧化氢分解的微粒可能是水分子
猜想二:促进过氧化氢分解的微粒可能是Na+
猜想三:促进过氧化氢分解的微粒可能是CO32-
小松同学指出,不可能是水分子促进了过氧化氢的分解.你赞成(填“赞成”或“不赞成”),你的理由是过氧化氢溶液中就存在水分子,没有加快反应速率.
【设计实验】
| 实验操作 | 实验现象 | 实验结论 | |
| 实验一 | 向6%3mL的过氧化氢溶液中加入1mL 10%的NaCl溶液,深入一根带火星的木条 | 促进过氧化氢分解的微粒不是Na+ | 猜想二不成立 |
| 实验二 | 向 6%3mL的过氧化氢溶液中,加入1mL10%的K2CO3溶液,伸入一根带火星的木条 | 促进过氧化氢分解的微粒是CO32- | 猜想三成立 |
2.硝酸盐分解很有规律.例如硫酸铜热分解可得氧化铜、四体积二氧化氮和一体积氧气,把硝酸铜热分解后产生的气体收集在一个大试管中,用带火星的木条检验,可以观察到的现象是( )
| A. | 带火星的木条复燃 | |
| B. | 带火星的木条与在空气中时现象一样 | |
| C. | 带火星的木条马上熄灭 | |
| D. | 无法判断 |
15. 牛牛同学设计了趣味实验装置(见图),其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( )
牛牛同学设计了趣味实验装置(见图),其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( )
 牛牛同学设计了趣味实验装置(见图),其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( )
牛牛同学设计了趣味实验装置(见图),其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( )| A. | 食盐和水 | B. | 硝酸铵和水 | C. | 镁和稀盐酸 | D. | 铜和稀硫酸 |
16.下列关于燃烧的现象的描述,不正确是( )
| A. | 硫在氧气中燃烧产生蓝紫色的火焰 | B. | 铁丝在氧气中燃烧火星四射 | ||
| C. | 蜡烛在空气中燃烧产生大量白烟 | D. | 木炭在氧气燃烧发出白光 |