题目内容
10.现有锻烧一段时间后的石灰石的样品,其质量是100g,将其充分锻烧后,得固体90g,将90g固体加入到足量的稀盐酸中,充分反应后过滤,得滤渣6g,则100g原固体中钙元素的质量分数是( )(杂质不和盐酸反应也不分解和溶解)| A. | 60% | B. | 50% | C. | 48% | D. | 40% |
分析 现有锻烧一段时间后的石灰石的样品100g中含有碳酸钙和氧化钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,将其充分锻烧后,得固体90g,为氧化钙和杂质的混合物;氧化钙与稀盐酸反应生成氯化钙和水,将90g固体加入到足量的稀盐酸中,充分反应后过滤,得滤渣6g,滤渣为不与稀盐酸反应的杂质,据此结合化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:现有锻烧一段时间后的石灰石的样品100g中含有碳酸钙和氧化钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,将其充分锻烧后,得固体90g,为氧化钙和杂质的混合物;氧化钙与稀盐酸反应生成氯化钙和水,将90g固体加入到足量的稀盐酸中,充分反应后过滤,得滤渣6g,滤渣为不与稀盐酸反应的杂质,即90g固体中氧化钙的质量为90g-6g=84g.
84g氧化钙中含钙元素的质量为84g×$\frac{40}{40+16}×$100%=60g.
由质量守恒定律,反应前后钙元素质量不变,则100g原固体中钙元素的质量分数为$\frac{60g}{100g}×$100%=60%.
故选:A.
点评 本题有一定难度,理顺反应的关系、灵活运用反应前后钙元素的质量不变是正确解答本题的关键.

练习册系列答案
相关题目
20.我们生活国所食用的盐是加碘食盐,根据如图提供的有关信息,下列说法错误的是( )


| A. | 碘的相对原子质量是126.9 | B. | 碘的元素符号是I | ||
| C. | 碘属于金属元素 | D. | 碘的原子序数是53 |
1.下列各项中,正确的是( )
| A. | 在C2H5OH+nO2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O中n=2 | |
| B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| C. | 清洗试管内壁固着的不溶性碱性残留物的步骤:蒸馏水润洗→自来水刷洗→稀盐酸润洗 | |
| D. | 植物油+水→溶液 |
5. 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜 想正确 |
| 乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加酚酞试液. | 溶液由无色 变为红色 | 自己的猜 想正确 |
【提出问题2】溶液B中溶质的成分是什么?加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
5.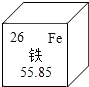 酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
 酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )| A. | 中子数为26 | B. | 核外电子数为26 | ||
| C. | 相对原子质量为55.85g | D. | 地壳中含量最高的金属元素 |
 我市某校研究性学习小组在老师指导下,对人类呼吸作用是否产生二氧化碳进行探究.现请你一同参与:
我市某校研究性学习小组在老师指导下,对人类呼吸作用是否产生二氧化碳进行探究.现请你一同参与:
