题目内容
4.某工业废水经初步处理,得到的母液中的溶质为Fe(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与母液反应,制取补血剂原料碳酸亚铁并回收铜.主要步骤如图1所示.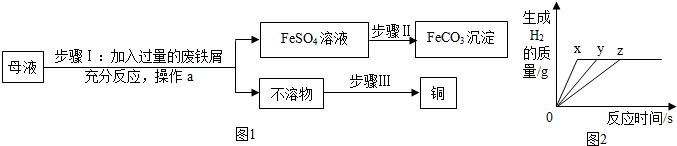
(1)步骤Ⅰ中,生成铜的化学方程式:Fe+CuSO4=Cu+FeSO4.
(2)Fe2(SO4)3与铁反应的化学方程式:xFe2(SO4)3+yFe═3FeSO4,其中x、y、z为化学计量数,z的值为3.
(3)步骤Ⅰ中,废铁屑含有少量铁锈,你认为对产物的成分没有(填“有”或“没有”)影响,原因是 (用化学方程式作答)3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe=3FeSO4.
(4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是Na2CO3(填化学式).
(5)步骤Ⅲ需加入的试剂是H2SO4(填化学式).
(6)在实验室里,有同学完成了以下实验:将等质量的镁、铁、锌三种金属分别放入三份溶液质量和溶质质量分数均相等的稀盐酸中,生成H2的质量与反应时间的关系如图2所示,则金属X是Mg(填化学式,下同),肯定有剩余的金属是Mg、Fe.
分析 (1)根据铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(2)根据质量守恒定律进行分析;
(3)根据铁锈和硫酸反应生成硫酸铁和水,硫酸铁和铁会生成硫酸亚铁进行分析;
(4)根据碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠进行分析;
(5)根据不溶物中含有置换出的铜和反应剩余的铁进行分析;
(6)根据金属的活动性以及反应原理来分析.
解答 解:(1)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;故填:Fe+CuSO4=Cu+FeSO4;
(2)通过分析xFe2(SO4)3+yFe=zFeSO4可知,依据化合价的升降,将方程式配平,所以Fe2(SO4)3+2Fe=3FeSO4,z的值为3;故填:3;
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;故填:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe=3FeSO4;
(4)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠;故填:Na2CO3;
(5)通过推导可知,不溶物中含有置换出的铜和反应剩余的铁,所以步骤Ⅲ回收铜的方法为:加入过量的稀硫酸,过滤、洗涤、干燥.故填:H2SO4;
(6)因为镁最活泼,反应时间少,则图线X表示镁的反应情况,因为三种金属生成的氢气质量相等,结合生成的氢气质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属质量,可知:锌可能反应完,镁、铁一定过量,故填:Mg;Mg、Fe.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.金属与酸反应的有关知识,综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题.


| A. | 10℃时,甲、乙两种物质的饱和溶液浓度相同 | |
| B. | 保持 20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液 | |
| C. | 30℃时,将 40g 甲物质加人 50g 水中,充分溶解后溶液的质量为 80g | |
| D. | 10℃时,将两种饱和溶液升温至 30℃,溶液中溶质的质量分数都增大 |
| A. | HCl | B. | O2 | C. | NH3 | D. | SO2 |
| A. | 真空包装食品 | B. | 在沥青公路上晒粮食 | ||
| C. | 给橙子“打蜡上色” | D. | 用工业酒精勾兑饮用酒 |
 根据装置图回答下列问题:
根据装置图回答下列问题:
 喜家德水饺是中国水饺餐饮连锁企业的领导品牌.喜家德秉承中华美食传统,结合现代健康饮食理念,精选上好食材,为顾客提供真材实料、现包现煮的美味健康水饺.目前遍布全国40多座城市,拥有连锁店面300多家,员工4000多人,已成为全国具影响力的专业水饺连锁领导品牌,请回答下列问题:
喜家德水饺是中国水饺餐饮连锁企业的领导品牌.喜家德秉承中华美食传统,结合现代健康饮食理念,精选上好食材,为顾客提供真材实料、现包现煮的美味健康水饺.目前遍布全国40多座城市,拥有连锁店面300多家,员工4000多人,已成为全国具影响力的专业水饺连锁领导品牌,请回答下列问题: