题目内容
12.下列属于化学变化的是( )| A. | 稀有气体通电发出有色光 | B. | 二氧化碳使澄清石灰水变浑浊 | ||
| C. | 氧气降温变成淡蓝色液体 | D. | 工业上分离液态空气制取氧气 |
分析 有新物质生成的变化叫化学变化,没有新物质生成的变化叫物理变化.化学变化的特征是:有新物质生成.判断物理变化和化学变化的依据是:是否有新物质生成.
解答 解:A、稀有气体通电发出有色光,属于物理变化,故选项错误;
B、二氧化碳使澄清石灰水变浑浊生成碳酸钙和水,属于化学变化,故选项正确;
C、氧气降温变成淡蓝色液体,属于物理变化,故选项错误;
D、工业上分离液态空气制取氧气,属于物理变化,故选项错误;
故选B
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.本考点主要出现在选择题和填空题中.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
2.下列符号中只有微观意义,没有宏观意义的是( )
| A. | H | B. | H2O | C. | 2H | D. | CO2 |
3.下列物质中,属于氧化物的是( )
| A. | C2H5OH | B. | P2O5 | C. | KCl | D. | O2 |
20.下列化学用语与意义对应不相符的是( )
| A. | O2:两个氧原子 | B. | 4Ne:4个氖原子 | ||
| C. | SiO2:二氧化硅 | D. | 2Mg2+:两个镁离子 |
7.以下各图所表示的实验操作中错误的是( )
| A. |  实验室制取氧气 | B. |  证明分子不断运动 | ||
| C. |  验满氧气 | D. |  测定空气中氧气的含量 |
4.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式2NaOH+H2SO4═Na2SO4+H2O
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中存在的错误是pH试纸直接插入待测液中,这样操作导致的结果是会将整个试剂污染,正确的操作是在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较.
(2)实验方案中也有一个是错误的请指出向待测液中滴加BaCl2溶液,错误的原因是滴加BaCl2溶液产生白色沉淀无法确定溶液中含有H2SO4,因为溶液中存在Na2SO4.
(3)若你是学习小组的一员,验证猜想二正确,你选用到试剂是紫色石蕊,现象是紫色石蕊变成红色.
(4)谈谈通过以上实验探究你的收获实验中要严谨求实.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式2NaOH+H2SO4═Na2SO4+H2O
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比标准比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中存在的错误是pH试纸直接插入待测液中,这样操作导致的结果是会将整个试剂污染,正确的操作是在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较.
(2)实验方案中也有一个是错误的请指出向待测液中滴加BaCl2溶液,错误的原因是滴加BaCl2溶液产生白色沉淀无法确定溶液中含有H2SO4,因为溶液中存在Na2SO4.
(3)若你是学习小组的一员,验证猜想二正确,你选用到试剂是紫色石蕊,现象是紫色石蕊变成红色.
(4)谈谈通过以上实验探究你的收获实验中要严谨求实.
1.溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水).
I.上表中的两种物质在40℃时,硝酸钾的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数$\frac{63.9g}{100g+63.9g}$×100%(不要求计算).
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法降低温度.
III.20℃时,将20g NaCl放入50g水中,所得溶液的质量是68gg.
IV.从NaCl溶液中得到NaCl晶体的方法是蒸发结晶.
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).
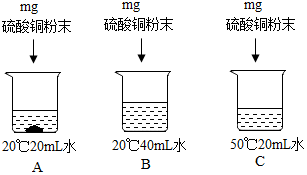
所得三个溶液中:一定属于饱和溶液的是A,溶液中溶剂质量的大小关系是B>C>A.
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水).
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| KNO3 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法降低温度.
III.20℃时,将20g NaCl放入50g水中,所得溶液的质量是68gg.
IV.从NaCl溶液中得到NaCl晶体的方法是蒸发结晶.
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).

所得三个溶液中:一定属于饱和溶液的是A,溶液中溶剂质量的大小关系是B>C>A.
2.能跟其他三种物质都发生反应的一种物质是( )
| A. | 氧化铜 | B. | 氧气 | C. | 焦炭 | D. | 二氧化碳 |