题目内容
18.实验室配制4%的氢氧化钠溶液200g,并用此溶液测定某盐酸的溶质质量分数.(1)配制200g质量分数为4%的氢氧化钠溶液.需要氢氧化钠固体的质量为8g.
(2)与25g某质量分数的盐酸恰好完全反应时,消耗4%的氢氧化钠溶液20g,试计算该盐酸中溶质的质量分数(请写出计算过程).
分析 (1)根据溶质的质量分数的计算公式可求出氢氧化钠的质量.
(2)利用化学方程式的计算可求出参加反应的盐酸中氯化氢的质量及其溶质的质量分数.
解答 解:(1)需要氢氧化钠固体的质量为:200g×4%=8g.
(2)设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
$\frac{40}{36.5}$=$\frac{20g×4%}{25gx}$
x=2.92%.
答:该盐酸中溶质的质量分数为2.92%.
点评 本题主要是有关溶质质量分数的计算及根据化学方程式进行的有关计算,在解答溶液的稀释问题时要注意根据在溶液稀释前后溶质的质量不变来进行解答.

练习册系列答案
相关题目
9.以下是我校某同学在化学小测中书写的化学方程式,其中不正确的是( )
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | ||
| C. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
6.有三瓶无色、无味的气体x、y、z,它们分别是甲烷、氢气、一氧化碳中的一种,分别点燃三种气体,用干燥的冷烧杯罩在火焰上方,只有y和z火焰上方的烧杯内壁有水滴出现.燃烧后分别向烧杯中注入澄清石灰水,振荡,只有x和y的烧杯内石灰水变浑浊.则x、y、z分别是( )
| A. | 甲烷、氢气、一氧化碳 | B. | 甲烷、一氧化碳、氢气 | ||
| C. | 一氧化碳、甲烷、氢气 | D. | 氢气、甲烷、一氧化碳 |
8.在实验室掌握正确的操作方法至关重要,下列实验操作正确的是( )
| A. | 加热后的试管,倒掉废液后立即用冷水冲洗 | |
| B. | 为了节约实验时间.可以随时向燃着的酒精灯内添加酒精 | |
| C. | 实验室制取C02时,先使试管倾斜,再用药匙取较大块大理石小心送至试管底部 | |
| D. | 量液时,量筒先放平,视线与液体凹面的最低处保持水平,再读数 |

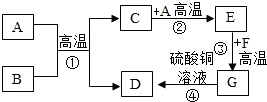 A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题:
A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题: 工业上以大理石和赤铁矿为主要原料制取B和G,其转化关系如图所示,已知D、G为单质.回答下列问题:
工业上以大理石和赤铁矿为主要原料制取B和G,其转化关系如图所示,已知D、G为单质.回答下列问题: