题目内容
15.下列各组物质中,前者是混合物,后者是化合物的是BA.冰水、镁带 B.空气、二氧化碳
C.红磷、食用精盐 D.一氧化碳.
分析 混合物中含有两种或两种以上物质,化合物是由不同元素组成的纯净物.
解答 解:A、冰水是由一种物质组成,属于纯净物,镁带是由一种元素组成,属于单质,故A错;
B、空气中含有氧气、氮气、二氧化碳等物质,属于混合物,二氧化碳由碳元素和氧元素组成,属于化合物,故B正确;
C、红磷由一种元素组成,属于单质,使用精盐中含有氯化钠和其它添加剂,属于混合物,故C错;
D、食盐水中含有氯化钠和水,属于混合物;一氧化碳由碳元素和氧元素组成,属于化合物.
故答案为:B;一氧化碳.
点评 解答本题关键是知道纯净物与混合物的区别:是否由一种物质组成;单质和化合物的区别:是否由一种元素组成.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.下列净水操作中,对水的净化程度最高的是( )
| A. | 蒸馏 | B. | 煮沸 | C. | 消毒 | D. | 沉淀 |
3. 小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL.
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是隔绝水、隔绝空气.
(2)实验过程
(3)反思分析
①金属钠与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
②反应结束,C中溶液变成无色后,其溶质是NaCl;NaCl和HCl(指示剂除外,写出所有可能).
③金属钠着火不能(填“能”或“不能”)用水把它浇灭.
④把金属钠放在空气中,经过一系列的变化后,最终的产物是Na2CO3.
 小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL.
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是隔绝水、隔绝空气.
(2)实验过程
| 操作 | 现象及解释 | |
| ① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞. | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中.金属钠的物理性质:银白色、熔点低、密度小于水的密度(或大于煤油). |
| ② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b. | 反应的化学方程式为CO2+2NaOH═Na2CO3+H2O. |
| ③ | 打开止水夹c | 反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
| ④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯. | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气. |
①金属钠与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
②反应结束,C中溶液变成无色后,其溶质是NaCl;NaCl和HCl(指示剂除外,写出所有可能).
③金属钠着火不能(填“能”或“不能”)用水把它浇灭.
④把金属钠放在空气中,经过一系列的变化后,最终的产物是Na2CO3.
20.下列关于空气及其成分的叙述中,错误的是( )
| A. | 氧气供呼吸,它与体内物质缓慢氧化,释放能量 | |
| B. | 空气中的氧气主要来自植物光合作用 | |
| C. | 氮气可作食品防腐的保护气 | |
| D. | 鱼、虾等能在水中生存,是由于氧气易溶于水 |
4.下列现象所作出的解释中正确的是( )
| A. | 金刚石很硬,石墨质软---------构成它们的碳原子不同 | |
| B. | 水烧开后易把壶盖冲起---------温度升高分子变大 | |
| C. | 一氧化碳和二氧化碳性质不同---------分子的构成不同 | |
| D. | 盐酸、硫酸溶液显酸性----------溶液中都含有酸根离子 |
5.下列各组物质中,都能与稀硫酸反应的一组是 ( )
| A. | Cu、CuO、Cu(OH)2 | B. | Fe、Fe(OH)2、FeCl3 | C. | Zn、ZnO、ZnCO3 | D. | Na、NaOH、NaNO3 |
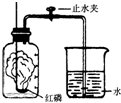 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下: 氮原子,
氮原子, 表示氢原子.请根据图示回答下列问题:
表示氢原子.请根据图示回答下列问题: