题目内容
17.用数字和符号表示填空:(1)2个铁原子2Fe;
(2)3个水分子3H2O;
(3)4个硝酸根离子4NO3-;
(4)铁锈的主要成分Fe2O3;
(5)用于改良酸性土壤的是Ca(OH).
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:(1)2个铁原子就是在铁元素符号的前面加上数字2,故填:2Fe;
(2)3个水分子就是在水的化学式的前面加上数字3,故填:3H2O;
(3)4个硝酸根离子就是在硝酸根离子的前面加上数字4,故填:4NO3-;
(4)铁锈的主要成分是氧化铁,故填:Fe2O3;
(5)用于改良酸性土壤的是氢氧化钙,故填:Ca(OH).
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列关于物质检验和区分的方法不正确的是( )
| A. | 用水检验NaOH、NH4NO3、CaCO3 | |
| B. | 用燃着的木条检验O2、CH4、CO2 | |
| C. | 用与熟石灰研磨区分CO(NH2)2、NH4Cl、(NH4)2SO4 | |
| D. | 用观察溶液颜色区分CuSO4溶液、Na2SO4溶液、FeSO4溶液 |
2.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:有Na2SO4、H2SO4和NaOH
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:Na2SO4.
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想一,其理由是H2SO4和NaOH在溶液中不能共存
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究中存在操作错误,请大家反思.同学们经过反思发现了这错误:实验操作中的错误是①pH试纸浸入溶液中;②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:有Na2SO4、H2SO4和NaOH
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:Na2SO4.
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想一,其理由是H2SO4和NaOH在溶液中不能共存
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 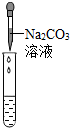 | 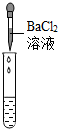 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究中存在操作错误,请大家反思.同学们经过反思发现了这错误:实验操作中的错误是①pH试纸浸入溶液中;②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
7.锰(Mn)和镍(Ni)都是金属,将镍丝插入硫酸锰溶液中,无变化;将镍丝插入硫酸铜溶液中,镍丝上铜析出.则Mn、Ni、Cu的金属活动性由强到弱排列正确的是( )
| A. | Mn Cu Ni | B. | Cu Ni Mn | C. | Ni Mn Cu | D. | Mn Ni Cu |
 ,它在化学反应中容易形成O2-.
,它在化学反应中容易形成O2-.
