题目内容
19.活性炭可用于净水,是因为活性炭可以吸附水中的色素和异味;新型净水剂K2FeO4可由下列反应制取:2X+3NaClO+4KOH═2K2FeO4+3NaCl+5H2O.则X的化学式为Fe(OH)3;除去硬水中过多的Ca2+和Mg2+(填离子符号)就可以得到软水.
分析 活性炭具有吸附性,可以吸附水中的色素和异味;根据质量守恒定律推断出x的化学式;根据离子符号的写法写出离子的符号.
解答 解:活性炭具有吸附性,活性炭可用于净水,是因为活性炭可以吸附水中的色素和异味;
在方程式2X+3NaClO+4KOH═2K2FeO4+3NaCl+5H2O的右边,有钾、铁、氧、钠、氯、氢的原子个数分别是4、2、13、3、3、10,左边有钾、氧、钠、氯、氢的原子个数分别是4、7、3、3、10,由于反应前后原子的种类及数目不变,可推出2X中共含有22个铁原子、6个氧原子和6个氢原子,所以X的化学式是:Fe(OH)3;
由于硬水是含有较多钙、镁离子的水,镁离子的符号为:Mg2+.
故答为:吸附,Fe(OH)3,Mg2+.
点评 本意的难度不大了解活性炭的吸附性、质量守恒定律、离子符号的写法即可解答本题.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
9.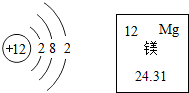 如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )
如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )
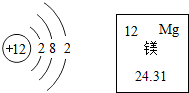 如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )
如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )| A. | 镁原子的质子数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁位于周期表中第3周期,第2主族 | |
| D. | 在化学反应中,镁原子容易失去2个电子 |
 为测定气球内的气体成分,有学生用超薄材料制成的气球按右图装置进行实验.开始时气球浮于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
为测定气球内的气体成分,有学生用超薄材料制成的气球按右图装置进行实验.开始时气球浮于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )




 将蘸有酒精的棉芯点燃后放入烧杯中,向其中倾倒二氧化碳,观察到火焰自下而上熄灭,如图所示
将蘸有酒精的棉芯点燃后放入烧杯中,向其中倾倒二氧化碳,观察到火焰自下而上熄灭,如图所示