题目内容
13.已知一托盘天平的左右两端各放相等质量、相同溶质质量分数的足量的硫酸溶液,现在左端放入N克的镁,右端放入N克的铜铝合金,则天平仍保持平衡,则合金中铜铝的质量之比( )| A. | 3:1 | B. | 2:1 | C. | 1:3 | D. | 1:2 |
分析 根据镁会与盐酸反应生成氯化镁和氢气,铝会与盐酸反应生成氯化铝和氢气,铜不会与盐酸反应,反应后天平仍然平衡,说明天平两边生成的氢气质量相等进行分析.
解答 解:托盘天平两边的稀盐酸和金属质量都相等,完全反应后,天平仍然平衡,所以两边生成的氢气质量相等,
Mg+2HCl═MgCl2+H2↑
24 2
2Al+6HCl═2AlCl3+3H2↑
54 6
18 2
通过比较化学方程式中,都生成2g氢气,参加反应的镁和铝分别是24g和18g,两边的金属质量相等可都为24g,符合题意,所以铜铝合金中的不反应铜质量为24g-18g=6g,所以合金中铜与铝的质量比是6g:18g=1:3.
故选:1:3.
点评 本题主要考查了镁铝锌铁和酸反应生成氢气的质量关系,题目新颖,需要在平时的学习中多加训练.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
4.检验糖尿病人的尿液,要配制8%的硫酸铜溶液200g.下列配制过程中正确的是( )
| A. | 只需托盘天平和量筒两种仪器 | |
| B. | 砝码放在左盘上,称取16g无水硫酸铜 | |
| C. | 用量筒量取184mL的水 | |
| D. | 把无水硫酸铜倒入量筒中搅拌溶解 |
1. 用“○”和“●”分别代表A、B两种原子,如图所示,单质A2与单质B2在一定条件下能发生化学反应生成新物质X.下列说法正确的是( )
用“○”和“●”分别代表A、B两种原子,如图所示,单质A2与单质B2在一定条件下能发生化学反应生成新物质X.下列说法正确的是( )
 用“○”和“●”分别代表A、B两种原子,如图所示,单质A2与单质B2在一定条件下能发生化学反应生成新物质X.下列说法正确的是( )
用“○”和“●”分别代表A、B两种原子,如图所示,单质A2与单质B2在一定条件下能发生化学反应生成新物质X.下列说法正确的是( )| A. | 在反应过程中A2和B2分子保持不变 | |
| B. | 该反应为置换反应 | |
| C. | 参加反应的A2与B2分子数之比为3:1 | |
| D. | 物质X含三种元素 |
8.要除去下列四种物质中的少量杂质(括号内的物质为杂质)甲:CaCO3(Na2CO3) 乙:NaOH(Na2CO3) 丙:KCl(KHCO3) 丁:炭粉(CuO)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发.下列组合正确的是( )
| A. | 甲-②,乙-③ | B. | 乙-③,丙-① | C. | 丙-①,丁-② | D. | 丁-①,丙-③ |
18.下列图示与对应的叙述不相符的是( )
| A. |  探究双氧水制氧气中MnO2的作用 探究双氧水制氧气中MnO2的作用 | |
| B. |  将水通电电解一段时间后的气体体积变化 将水通电电解一段时间后的气体体积变化 | |
| C. |  20℃时向不饱和KNO3溶液中继续加KNO3后溶质质量分数变化 20℃时向不饱和KNO3溶液中继续加KNO3后溶质质量分数变化 | |
| D. |  向两份完全相同的盐酸中分别加入足量锌粉、镁粉 向两份完全相同的盐酸中分别加入足量锌粉、镁粉 |
5.在氧气中燃烧,会产生浓厚白烟的是( )
| A. | 红磷 | B. | 木炭 | C. | 硫磺 | D. | 铁丝 |
2.生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.

探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.

探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
| 实验橾作 | 实验现象 | 实验结论 |
| ①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 CO2、H2O、CuO;铜绣由Cu、C、H、O元素组成;烧杯中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O. |
| ③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
| 序号 | 实验内容 | 实验结论 | 实验反思 |
| 实验1 | 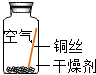 | 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 除去蒸馏水中溶解的O2和CO2. (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 按实验4内容重复操作后,再通入一定量的CO2排出部分空气,塞紧胶塞. |
| 实验2 | 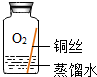 | 在有O2和H2O、无CO2的环境中,铜不易生锈 | |
| 实验3 | 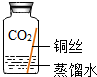 | 在有CO2和H2O、无O2的环境中,铜不易生锈 | |
| 实验4 | 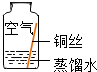 | 铜生锈的条件是 与O2、CO2和H2O同时接触 |

