题目内容
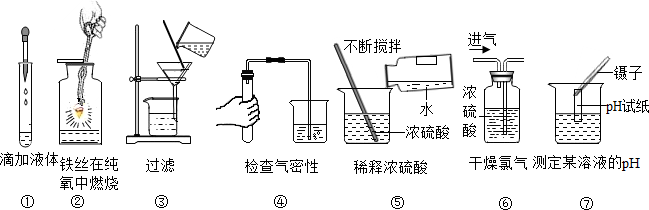
11.根据实验装置图,回答下列问题:
(1)用过氧化氢溶液和二氧化锰混合制取氧气应选用的发生装置是B.
(2)如装置F所示,点燃两支短蜡烛,然后沿烧杯内壁倾倒二氧化碳时,看到F中的实验现象是蜡烛由低到高依次熄灭.
(3)某同学选用G装置进行实验,看到与上一步实验F中完全相同的实验现象,他由此得出与上一步实验完全相同的结论.此结论(答“合理”或“不合理”)不合理.
(4)检查装置C中气体收集满的方法是瓶口产生气泡.
分析 根据气体的制取发生装置的选择方法、二氧化碳的性质以及气体集满方法进行分解答即可.
解答 解:(1)用过氧化氢溶液和二氧化锰混合制取氧气是固液常温型反应,应该选择B装置,故填:B;
(2)二氧化碳不支持燃烧也不燃烧,且密度大于空气,故将二氧化碳沿烧杯壁倒下,会观察到蜡烛由低到高依次熄灭,故填:蜡烛由低到高依次熄灭;
(3)由于是将二氧化碳直接通到烧杯底部,故不能得出二氧化碳密度大于空气的结论,故填:不合理;
(4)C装置是排水法收集气体,判断收集满的标志是瓶口产生大气泡,故填:瓶口产生气泡.
点评 本题考查的是常见气体的实验室制取的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
2.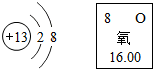 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
(4)某同学取100g含有H2SO4的酸性废水,然后滴加烧碱溶液中和,至溶液pH=7时,共消耗质量分数为20%的烧碱溶液20g.求这种废水中含H2SO4的质量分数.
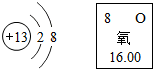 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐渐加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
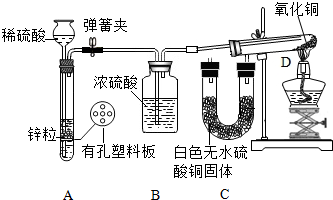
19. 小明设计了一个趣味喷泉实验装置(如图),其气密性良好.但实验时,当将A中的固体和液体混合后,B中尖嘴导管处并没有有“喷泉”产生.请你分析:A中加入的固体和液体可能是( )
小明设计了一个趣味喷泉实验装置(如图),其气密性良好.但实验时,当将A中的固体和液体混合后,B中尖嘴导管处并没有有“喷泉”产生.请你分析:A中加入的固体和液体可能是( )
 小明设计了一个趣味喷泉实验装置(如图),其气密性良好.但实验时,当将A中的固体和液体混合后,B中尖嘴导管处并没有有“喷泉”产生.请你分析:A中加入的固体和液体可能是( )
小明设计了一个趣味喷泉实验装置(如图),其气密性良好.但实验时,当将A中的固体和液体混合后,B中尖嘴导管处并没有有“喷泉”产生.请你分析:A中加入的固体和液体可能是( )| A. | 碳酸钠和盐酸 | B. | 氯化钡和稀硫酸 | ||
| C. | 二氧化锰和过氧化氢溶液 | D. | 锌粉和稀硫酸 |
16.请将干冰的化学式填在下表中相应的位置,并根据下表回答有关问题:(各小题均用序号填空)
(1)表中的物质属于单质的是②.
(2)表中的物质可用燃料的是①,可用于制肥皂、造纸等工业的碱是③.
(3)若要测定某烧碱溶液的酸碱度,应选用下列选项中的③.
①无色酚酞溶液 ②紫色石蕊溶液 ③pH试纸.
| 序号 | ① | ② | ③ | ④ |
| 物质名称 | 甲烷 | 氧气 | 烧碱 | 干冰 |
| 化学式 | CH4 | O2 | NaOH |
(2)表中的物质可用燃料的是①,可用于制肥皂、造纸等工业的碱是③.
(3)若要测定某烧碱溶液的酸碱度,应选用下列选项中的③.
①无色酚酞溶液 ②紫色石蕊溶液 ③pH试纸.
3.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质质量如表:
下列推断不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 8 | 1 | 36 | 10 |
| 反应后质量(g) | 待测 | 20 | 0 | 31 |
| A. | 甲待测的质量值为4 | B. | 该反应的类型不可能是分解反应 | ||
| C. | 该反应的类型可能是化合反应 | D. | 该反应遵守质量守恒定律 |