题目内容
3. 化学反应有多种分类方法.
化学反应有多种分类方法.(1)化学反应可分为氧化还原反应和非氧化还原反应.某种元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应.据此可判断下列化学反应属于氧化还原反应的是②⑤⑥.
①Zn0+H2SO4=ZnS04+H20
②Fe2O3+3C0$\frac{\underline{\;高温\;}}{\;}$2Fe+3C02
③Na2C03+2HCl=2NaCl+H20+C02↑
④CaC03$\frac{\underline{\;高温\;}}{\;}$Ca0+C02↑
⑤2C+Si02$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
⑥4CuSO4$\frac{\underline{\;高温\;}}{\;}$4CuO+2SO3↑+2S02↑+O2↑
(2)化学反应可分为四大基本反应类型.已知甲、乙、丙、丁四种物质在化学反应中的关系为:甲+乙→丙+丁.下列说法正确的是④.
①若取10g甲和20g乙反应,则生成的丙和丁的质量总和一定为30g.
②若丙和丁分别为盐和水,则甲和乙一定属于酸和碱.
③若该反应为复分解反应,则生成物中一定有水.
④若甲和丁均为单质,乙和丙均为化合物,则该反应一定属于置换反应.
(3)分析如图,其为常见物质间的转化关系(只省略了部分生成物).
讨论一:若丙为CO2,甲和乙为常见的碱.X与Z具有相似的化学性质.写出一个能反映X或Z的化学性质的化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑.丁物质的类别可能为①③(填序号).
①酸 ②碱 ③盐
讨论二:若丙为铁,w为水,且图中的四个反应中有2个置换反应、2个复分解反应,写出W生成Z的化学反应方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
讨论三:若甲、乙、丙、丁四种物质中只有一种是氧化物,其余是单质;X、Y、Z都是氧化物,W是红色固体单质.则X的化学式为CO.Y与Z发生化合反应的化学方程式为CO2+H2O=H2CO3..
分析 (1)根据题干提供的信息进行分析,元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应,据此解答;
(2)①、在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.这就叫做质量守恒定律;
②、若丙和丁分别为盐和水,则甲和乙可能是酸和碱,也可能是酸和氧化物;
③、由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应;
④、置换反应是单质与化合物反应生成另外的单质和化合物的化学反应.
(3)讨论一:根据丙为二氧化碳,甲乙是常见的碱,所以X、Z是碳酸盐,盐会与酸反应,会与盐反应等等,根据甲是碱,会与碱反应的物质有盐或酸进行分析.
讨论二:根据丙为铁,W为水,四个反应中有2个置换反应、2个复分解反应,所以乙是酸,Z就是氢气进行分析
讨论三:根据W是红色固体单质,所以D就是铜,X、Y、Z是氧化物,所以乙就是氧化铜,丁就是氢气,甲、乙、丙、丁四种物质中只有一种是氧化物,所以丁就是氢气,Z就是二氧化碳,丙就是碳,所以甲就是氧气X就是一氧化碳,Y就是水,将推出的物质带入图中验证即可.
解答 解:
(1)①ZnO+H2SO4=ZnSO4+H2O,该反应前后元素的化合价没有发生改变,不是氧化还原反应,故错误;
②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,该反应中,反应前铁元素的化合价是+3,反应后铁元素的化合价为0,反应前碳元素的化合价是+2,反应后碳元素的化合价是+4,元素的化合价发生改变,属于氧化还原反应,故正确;
③Na2CO3+BaCl2=BaCO3↓+2NaCl,该反应前后元素的化合价没有发生改变,不是氧化还原反应,故错误;
③④CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,该反应前后元素的化合价没有发生改变,不是氧化还原反应,故错误;
⑤2C+Si02$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,该反应中,反应前C元素的化合价是0,反应后C元素的化合价为+2,反应前硅元素的化合价是+4,反应后硅元素的化合价是0,元素的化合价发生改变,属于氧化还原反应,故正确;
⑥4CuSO4$\frac{\underline{\;高温\;}}{\;}$4CuO+2SO3↑+2S02↑+O2↑,该反应中,反应前硫元素的化合价是+6,反应后硫元素的化合价为+4,反应前氧元素的化合价是-2,反应后氧元素的化合价是0,元素的化合价发生改变,属于氧化还原反应,故正确;
(2)①、若取10g甲和20g乙正好完全反应,则生成的丙和丁的质量总和一定为30g.故A不正确;
②、若丙和丁分别为盐和水,则甲和乙可能是酸和碱,也可能是酸和氧化物;故B不正确;
③、若该反应为复分解反应,生成物中不一定有水生成;如一种碱与一种盐反应,生成另一种碱和盐.故C不正确;
④、若甲和丁均为单质,乙和丙均为化合物,则该反应符合置换反应的特点,一定属于置换反应.故D正确.
(3)讨论一:丙为二氧化碳,甲乙是常见的碱,所以X、Z是碳酸盐,盐会与酸反应,会与盐反应,故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
甲是碱,会与碱反应的物质有盐或酸,故答案为:①③
讨论二:丙为铁,W为水,四个反应中有2个置换反应、2个复分解反应,铁作为反应物,只能参与置换反应,所以应该是与酸或者不活泼金属对应的可溶性盐溶液反应.那么丁对应的就是应该是复分解反应,由于W为水,所以乙是酸,Z就是氢气,故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
讨论三:W是红色固体单质,所以w就是铜,X、Y、Z是氧化物,所以乙就是氧化铜,丁就是氢气,甲、乙、丙、丁四种物质中只有一种是氧化物,所以丁就是氢气,Z就是二氧化碳,丙就是碳,所以甲就是氧气X就是一氧化碳,Y就是水,经过验证各种物质都满足转换关系,故答案为:CO; CO2+H2O=H2CO3.
答案:
(1)②⑤⑥;
(2)④;
(3)讨论一:Na2CO3+2HCl=2NaCl+H2O+CO2↑;①③;
讨论二:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
讨论三:CO; CO2+H2O=H2CO3.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 名校课堂系列答案
名校课堂系列答案| A. | F | B. | O2- | C. | NH4+ | D. | OH- |
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 物质的量是表示一定数目微粒的集合体 | |
| C. | 1个碳原子的质量是12g | |
| D. | 物质的量就是物质的质量 |
| A. | 若丙、丁为盐和水,则甲、乙一定是酸和碱 | |
| B. | 若将10g甲和15g乙混合,充分反应后,则生成丙和丁的质量总和一定为25g | |
| C. | 若甲、乙、丙、丁都是化合物,则该反应一定是复分解反应 | |
| D. | 若甲为碳水化合物,乙为氧气,则该反应一定为氧化反应 |
 某反应的微观示意图如图所示.
某反应的微观示意图如图所示. .
.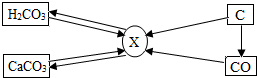 碳和部分碳的化合物间转化关系如图所示.
碳和部分碳的化合物间转化关系如图所示.