题目内容
14.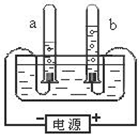 实验是化学学习的一种重要 手段,如利 用电解水实验可探究水的组成.请根据电解水实验回答下列问题:
实验是化学学习的一种重要 手段,如利 用电解水实验可探究水的组成.请根据电解水实验回答下列问题:(1)通电后电极上出现气泡并汇集到试管上端.则正极产生的气体是氧气,负极产生的气体是氢气,正极、负极产生的气体的体积比是1:2
(2)实验时常在水中加入硫酸或氢氧化钠,目的是:增强导电性.
(3)水通电后发生化学变化 变化,文字表达式为水$\stackrel{通电}{→}$氢气+氧气.
分析 根据电解水实验的现象和结论以及生成气体的性质分析回答有关的问题,根据反应写出反应的文字表达式.
解答 解:(1)电解水实验的现象是电极上出现气泡,正极上产生气体体积与负极气体体积比为1:2,正极产生的氧气能使带火星的木条复燃,负极产生的气体能够燃烧,并发出淡蓝色火焰,是氢气;
(2)纯水不易导电,所以实验时常常在水中加入硫酸或氢氧化钠,目的是增强水的导电性;
(3)电解水生成了新物质,所以是化学变化,反应的表达式为:水$\stackrel{通电}{→}$氢气+氧气;
故答案为:(1)氧气;氢气;1:2;
(2)增强导电性;
(3)化学变化;水$\stackrel{通电}{→}$氢气+氧气.
点评 本题主要考查学生对电解水实验的掌握情况,学生只要熟知此实验的过程、现象,能正确书写反应的化学方程式,就能轻松答题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.石膏法制取硫酸钾具有能耗低,原料来源广等优点而被探索.以硫酸钙与氯化钾为原料制备硫酸钾的流程如图:

已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
(1)氨水显碱性(填“酸性”、“碱性”或“中性”),向水中连续通氨气达两个小时可得高浓度氨水,氨气不断溶解使溶液pH增大(填“增大”、“减小”或“不变”).上表中“非常压”指需增大气压才能形成30℃的氨(35%)溶液,常压下不能形成30℃的氨(35%)溶液的原因是常压30℃时氨气在水中达到饱和时浓度小于35%.
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是氨水浓度越大,硫酸钾溶解度越小,沉淀池温度适宜保持在低温(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为NH3;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为7:5.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)检验沉淀是否洗净的试剂是AB(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液.

已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
| 温度(℃) | 0 | 10 | 26 | 30 |
| 水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
| 氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
| 氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是氨水浓度越大,硫酸钾溶解度越小,沉淀池温度适宜保持在低温(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为NH3;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为7:5.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)检验沉淀是否洗净的试剂是AB(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液.
9.钛的熔点高,密度小,抗腐蚀性能好,在航天工业和化学工业中用途广泛,已知钛原子的核电荷数为22,中子数为26,则该原子的质子数和相对原子质量分别是( )
| A. | 48,26 | B. | 22,48 | C. | 26,48 | D. | 4,22 |
19.X可以发生如下反应:①X与酸反应生成盐和水;②X与非金属氧化物反应生成盐和水,X可能是( )
| A. | 氧化铜 | B. | 盐酸 | C. | 氢氧化钠 | D. | 碳酸钠 |
3.某校科技节的实验比赛中,老师向大家展示了四瓶白色粉末.分别是KC1、NH4HCO3、K2SO4、(NH4)2SO4
(1)某同学首先通过闻气味,打开试剂瓶塞时闻到剌激性气味的是NH4HCO3,用化学方程式表明理由:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(2)请设计实验方案.区别剩余三种白色粉末,写出实验步驟、预期现象以及结论,限选药品:稀HC1、BaCl2溶液、AgNO3溶液、蒸馏水、熟石灰粉末、常用实验仪器任选.
(1)某同学首先通过闻气味,打开试剂瓶塞时闻到剌激性气味的是NH4HCO3,用化学方程式表明理由:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(2)请设计实验方案.区别剩余三种白色粉末,写出实验步驟、预期现象以及结论,限选药品:稀HC1、BaCl2溶液、AgNO3溶液、蒸馏水、熟石灰粉末、常用实验仪器任选.
| 实验步骤 | 现象及预期结沦 |
| 1.分别取样与熟石灰粉末混合研磨;2.另取少量剩余的两种样品,分别滴加氯化钡溶液 | 产生有刺激性气味的气体气体的是(NH4)2SO4;产生白色沉淀的是硫酸钾溶液,无明显变化的是氯化钾溶液 |
 如图中的A~I表示几种初中化学常贝的纯争物,A、B、C、I是单质,其他均是氧化物;C是紫红色金属,D是磁铁矿石的主要成分,固态的H叫“干冰”.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.
如图中的A~I表示几种初中化学常贝的纯争物,A、B、C、I是单质,其他均是氧化物;C是紫红色金属,D是磁铁矿石的主要成分,固态的H叫“干冰”.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.