题目内容
20.为探究气体X的组成,某兴趣小组进行如图所示实验(固定装置未画出).【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气.
(2)碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应.
(3)无水氯化钙可吸收气体X.
(4)本实验条件下,氮气密度为1.15g•L-1,装置内空气对相关数据测定的影响可忽略不计.
【实验步骤】
(1)连接仪器,并检查装置气密性.
(2)取一定量氧化铜,准确称得其质量为2.40g.
(3)按如图所示装入药品,测量并记录相关数据Ⅰ(见下表).
(4)连接A、B、C装置,将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热.当A装置中氧化铜反应完全,停止加热,继续通入气体X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见下表).
【实验装置】
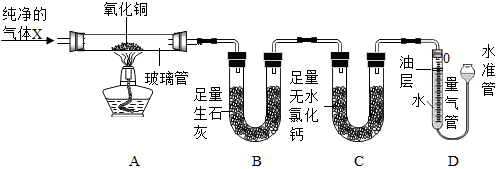
【相关数据】
| 项目 | Ⅰ | Ⅱ |
| 玻璃管(含药品)的质量/g | 52.40 | 51.92 |
| B装置(含药品)的质量/g | 102.00 | 102.54 |
| 氮气的体积/mL | / | 243.5 |
(1)B装置中氧化钙吸水的原理为CaO+H2O=Ca(OH)2(用化学方程式表示).
(2)实验过程中,当观察到量气管内液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是防止灼热的铜被氧化.
(3)分析实验测量的数据,生成水的质量为0.54g,氧化铜中氧元素的质量为0.48g.由此推知,气体X中一定没有(填“有”或“没有”)氧元素.
(4)通过计算推导出气体X的化学式为NH3.
分析 根据题目的信息可知:B装置中的碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应,因此只吸收水蒸气,增加的质量就是生成的水的质量:102.54g-102.00g=0.54g;氧化铜中氧元素的质量=52.40g-51.92g=0.48g;由此推知,气体X中一定没有氧元素,因为0.54g水中氧元素的质量=0.54g×$\frac{16}{18}$=0.48g;B装置中氧化钙吸水的原理为:氧化钙和水反应生成氢氧化钙;实验过程中,当观察到量气管内液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃冷却的目的是防止灼热的铜被氧化;根据元素的质量比求x的化学式,有关的计算要准确.
解答 解:(1)B装置中氧化钙吸水的原理为:氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(2)实验过程中,当观察到量气管内液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃冷却的目的是防止灼热的铜被氧化;
(3)B装置中的碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应,因此只吸收水蒸气,增加的质量就是生成的水的质量:102.54g-102.00g=0.54g,0.54g水中氧元素的质量=0.54g×$\frac{16}{18}$=0.48g,氧化铜中氧元素的质量=52.40g-51.92g=0.48g,由此推知,气体X中一定没有氧元素;
(4)243.5mL=0.2345L,设气体x的化学式为NmHn
$\frac{氮元素质量}{氢元素质量}$=$\frac{14m}{n}$=$\frac{1.15g•L-1×0.2435L}{0.54g-0.48g}$
$\frac{m}{n}$≈$\frac{1}{3}$
所以x的化学式为:NH3.
故答案为:(1)CaO+H2O═Ca(OH)2;
(2)量气管内液面不再下降,防止灼热的铜被氧化;
(3)0.54,0.48,没有;
(4)NH3.
点评 本题既考查了实验步骤的设计,又考查了化学方程式的书写和有关的计算等,还对实验进行了评价,综合性比较强,有关的计算要正确.同学们要具体分析,综合掌握.

| A. | 铁丝在空气中燃烧火星四射,生成黑色固体物质 | |
| B. | 木炭在氧气中燃烧生成二氧化碳 | |
| C. | 硫在氧气中燃烧,发出蓝紫色火焰 | |
| D. | 红磷在空气中燃烧,产生大量白雾 |
| A. | 9.288×10-26 kg | B. | 9.288×10-26 | C. | 56 kg | D. | 56 |
 2013年,我省粮食生产在大灾之年再夺丰收.小麦和玉米是黑龙江省主要植的粮食作物.
2013年,我省粮食生产在大灾之年再夺丰收.小麦和玉米是黑龙江省主要植的粮食作物.
 A、B…H八种物质,有如图所示关系:其中A是紫黑色(暗紫色)固体,E是白色固体,H是黑色固体,在②的反应前后B的质量和化学性质都不改变.试推断:
A、B…H八种物质,有如图所示关系:其中A是紫黑色(暗紫色)固体,E是白色固体,H是黑色固体,在②的反应前后B的质量和化学性质都不改变.试推断: