题目内容
3.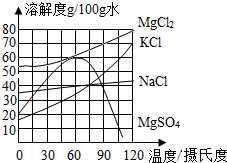 食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富,通过晾晒海水可以得到粗盐和卤水.如图所示为NaCl及卤水主要成分的溶解度曲线图.
食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富,通过晾晒海水可以得到粗盐和卤水.如图所示为NaCl及卤水主要成分的溶解度曲线图.(1)海水晒盐的原理是利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来;
(2)60℃时,100g水中加入80gKCl,充分搅拌后观察到的现象是有部分KCl未溶解.所形成的溶液是饱和溶液(填“饱和”或“不饱和”).
(3)90℃时,MgCl2溶液的最大浓度(溶质质量分数)为$\frac{70g}{100g+70g}×100%$(只列计算式,不需要计算结果).
(4)将90℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至30℃时,没有晶体析出的是MgSO4(填物质名称).
分析 (1)食盐的溶解度受温度影响变化不大,利用海水晒盐,是利用了蒸发结晶的原理,据此进行分析解答.
(2)根据在60℃时KCl的溶解度分析判断回答;
(3)根据在90℃时,MgCl2溶液溶解度计算;
(4)根据MgCl2、KCl和MgSO4三种物质的溶解度随温度变化的情况分析回答.
解答 解:(1)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来.
(2)由KCl的溶解度曲线可知,在60℃时,KCl的溶解度是35.5g,100g水中加入80gKCl,充分搅拌后观察到的现象是有部分KCl未溶解,所形成的溶液是饱和溶液.
(3)由MgCl2的溶解度曲线可知,在90℃时,MgCl2溶液的溶解度是70g,在90℃时,MgCl2饱和溶液的浓度最大,为:$\frac{70g}{100g+70g}×100%$;
(4)将90℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至30℃时,由于MgSO430℃时溶解度大于90℃时的溶解度,没有晶体析出.
故答案为:(1)利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来.(2)有部分KCl未溶解,饱和溶液;(3)$\frac{70g}{100g+70g}×100%$;(4)MgSO4.
点评 解答本题关键是要知道海水晒盐的原理,溶解度曲线的意义以及饱和溶液与不饱和溶液的判断及转化等知识.

练习册系列答案
相关题目
9.常见金属X与硝酸银溶液反应的化学方程式为X+3AgNO3═3Ag+X(NO3)3,有关该反应说法错误的是( )
| A. | 该反应是置换反应 | B. | X可能是铁 | ||
| C. | 金属活动性X>Ag | D. | X表面有固体析出 |
14.氢氧化铝是一种不溶于水的白色固体,能与稀盐酸反应,也能与氢氧化钠溶液反应.氢氧化铝与氢氧化钠溶液反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O.下列有关说法错误的是( )
| A. | 氢氧化铝属于碱 | |
| B. | NaAlO2中铝元素的化合价为+3价 | |
| C. | 向氯化铝溶液中逐滴加入过量的氢氧化钠溶液,先产生白色沉淀,后沉淀不消失 | |
| D. | 向稀盐酸中加入氢氧化铝,发生中和反应 |
18.某溶液的pH值为9,微粒使pH值降到6以下,应滴加( )
| A. | 石灰水 | B. | 盐酸 | C. | 水 | D. | 氯化钠溶液 |
8.某NaOH固体样品,可能含有固体KOH和不溶于酸的杂质A,取5.6g该样品与100g一定质量分数的稀盐酸反应,两者恰好完全反应,生成mg水.下列说法正确的是( )
| A. | 若样品不含任何杂质,则m<1.8 | |
| B. | 若m=1.8,则样品中一定含有杂质A,可能含有固体KOH | |
| C. | 若m>1.8,则样品中一定含有固体KOH,可能含有杂质A | |
| D. | 若样品中不含A,则盐酸的溶质质量分数可能为4% |
13.如图所示实验操作正确且能达到实验目的是( )
| A. |  稀释浓硫酸 | B. |  称量固体氢氧化钠质量 | ||
| C. |  测定溶液pH | D. |  比较铁与铜的活动性 |
