题目内容
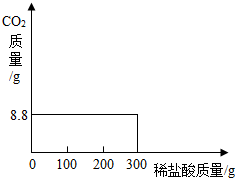
向25.8 g含少量氯化钠杂质的碳酸钠白色固体中慢慢加人10%的稀盐酸,到恰好不再产生气体为止,共收集到8.8 g干燥的二氧化碳气体.求:
(1)白色固体中碳酸钠的质量分数是多少?
(2)所得溶液中氯化钠的质量分数是多少?
解析:
|
解:设白色固体中碳酸钠的质量为x,反应中生成氯化钠的质量为y,参加反应的纯HCl的质量为z 白色固体中碳酸钠的质量分数是21.2 g/25.8 g×100%=82.8% 117/44=y/8.8 g y=23.4 g 73/44=z/8.8 g z=14.6 g 反应中所需盐酸的质量为14.6 g÷10%=146 g 原白色固体中氯化钠的质量为25.8 g-21.2 g=4.6 g 反应后所得溶液中溶质的质量为4.6 g+23.4 g=28 g 反应后所得溶液的质量为146 g+25.8 g-8.8 g=163 g 所得溶液中氯化钠的质量分数为28 g/163 g×100%=17.2% 点拨:这是一道溶质质量分数与化学方程式的计算相结合的综合题.由8.8 g二氧化碳的质量可以计算出参加反应的纯HCl的质量,根据稀盐酸的质量分数可以求出稀盐酸的质量. 误区突破:学生在书写化学方程式时不配平;所得溶液中的溶质质量只注重生成的氯化钠的质量,而忘记了原混合物中的氯化钠质量;反应后所得溶液的质量算错. 小结:反应后溶液的质量可用下列方法计算:反应后溶液的质量=放入且溶解的固体物质的质量+倒入的溶液的质量-反应生成的气体(或沉淀的质量). |

 名题金卷系列答案
名题金卷系列答案
| |||||||||||

 (2003?扬州)在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl.
(2003?扬州)在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl.
