题目内容
4. 有一瓶标签破损的稀硫酸(如图1),为测定其溶质质量分数,取出7g该溶液,加入足量的锌粒,产生氢气的质量与反应时间关系如图2.请计算:该溶液中溶质的质量分数.
有一瓶标签破损的稀硫酸(如图1),为测定其溶质质量分数,取出7g该溶液,加入足量的锌粒,产生氢气的质量与反应时间关系如图2.请计算:该溶液中溶质的质量分数.(化学方程式:Zn+H2SO4═ZnSO4+H2↑)
分析 根据稀H2SO4与NaOH溶液的反应的方程式,由NaOH的质量求出稀H2SO4的溶质稀H2SO4的溶质质量分数,
再求出稀H2SO4的溶质质量分数.
解答 解:7g稀硫酸样品含有H2SO4的质量为x
Zn+H2SO4═ZnSO4+H2↑
98 2
x 0.02g
$\frac{98}{x}=\frac{2}{0.02g}$
解得:x=0.98g
稀H2SO4的溶质质量分数为$\frac{0.98g}{7g}$×100%=14%
答:稀H2SO4的溶质质量分数是14%.
点评 此题是一道结合图象的计算题,利用化学方程式的计算进行解决是解题的突破口.

练习册系列答案
相关题目
19.下列四个图象分别对应四种操作过程,其中不正确的是( )
| A. | 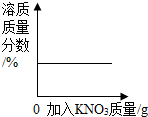 向饱和KNO3溶液中加入KNO3 | |
| B. | 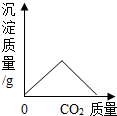 向CaCl2溶液中通入CO2 | |
| C. | 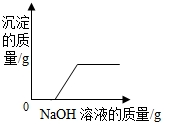 向CuCl2和HCl的混合溶液中加入过量NaOH溶液 | |
| D. | 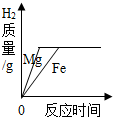 向两份同体积和同质量分数的HCl溶液中分别加入足量的铁粉和镁粉 |
15.下列离子方程式正确的是( )
| A. | 铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铁和铜反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 石灰水与碳酸钠溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
16.以下知识梳理中,错误的是( )
A | 物质的性质与用途 | B | 元素与人体健康 |
| 氮气性质稳定--用作保护气 氢气有可燃性--作绿色燃料 | 人体缺铁--易患贫血症 人体缺钙--易骨质疏松 | ||
C | 安全常识 | D | 化学之最 |
| 煤气泄漏--关闭阀门轻开门窗 加热液体--试管口不能对着人 | 天然存在的最硬的物质--大理石 人体里含量最多的元素--钙元素 |
| A. | A | B. | B | C. | D |

