题目内容
9. 将等质量的锌粉和铁粉,分别放入质量相等、溶质质量相等的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图,下列说法正确的是( )
将等质量的锌粉和铁粉,分别放入质量相等、溶质质量相等的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图,下列说法正确的是( )| A. | M表示铁和稀硫酸的反应 | B. | 两个都属于分解反应 | ||
| C. | 反应结束后铁一定有剩余 | D. | 反应结束后溶液质量相等 |
分析 由已知:“用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应”,结合图象产生的氢气的质量相等可知两个烧杯中的稀硫酸均反应完全.
根据锌的活动性比铁的活动性强,因此锌反应的时间短,据此分析解答;
由于稀硫酸均已反应完全,根据Zn~H2SO4,Fe~H2SO4,Zn和Fe的相对原子质量不用,因此消耗的金属质量不相等,据此解答;
根据生成的氢气质量相等,所以可知硫酸均反应完;
根据Zn~H2SO4,Fe~H2SO4,Zn和Fe的相对原子质量不用,因此消耗的金属质量不相等.
解答 解:根据氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量进行分析如下:
A、因为锌的活动性比铁的活动性强,因此锌反应的时间短,曲线M表示锌和稀硫酸的反应,故A错误;
B、根据Zn与H2SO4,Fe与H2SO4的反应,可知符合“单+化=单+化”的特点,为置换反应,故B错误;
C、由于稀硫酸均已反应完全,根据Zn~H2SO4,Fe~H2SO4,Zn和Fe的相对原子质量不用,因此消耗的金属质量不相等,由于铁的相对分子质量较小,因此产生等质量的氢气消耗的铁较少,可知铁一定有剩余,故C正确;
D、根据生成的氢气质量相等,消耗的金属质量不相等,故反应结束后溶液质量不相等,故D错误.
故选C.
点评 本题主要考查了金属的化学性质及其应用,掌握金属活动性顺序及其应用和酸的化学性质;学会利用化学方程式的计算来解决问题.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
14.同学们对一做法进行的下列分析,你认为不合理的是( )
| A. | 用熟石灰改良过的酸性土壤.不能立即施加氮肥 | |
| B. | 将草木灰(主要成分是碳酸钾)和碳铵混合施用有利于提高肥效 | |
| C. | 化肥施加过多会随雨水流入河中,造成水华现象 | |
| D. | 铵态氮肥不能与碱性物质混合施用,是由于二者反应降低肥效. |
20.分类法是我们研究物质的基本方法,下列物质中,属于纯净物的是( )
| A. | 白酒 | B. | 石灰石 | C. | 氮气 | D. | 不锈钢 |
17.小金做除去物质所含少量杂质的四个实验,方法正确的是( )
| 物 质 | 所含杂质 | 除去杂质的方法 | |
| A | Cu(NO3)2溶液 | AgNO3 | 加过量铜粉,过滤 |
| B | O2 | CO2 | 通过灼热的铜网 |
| C | KCl溶液 | BaCl2 | 加适量的Na2SO4溶液,过滤 |
| D | CO2 | HCl | 通过盛有NaOH溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
4.实验室用含有杂质的锌粒(杂质既不溶于水,也不参与反应)和稀硫酸反应制取氢气.实验结束后,容器内已无气泡产生,但还有少量固体物质剩余.若要检验反应后的溶液是否有稀硫酸,则下列方法错误的是
( )
( )
| A. | 往容器内滴加紫色石蕊试液,若石蕊试液变红,则溶液一定有稀硫酸 | |
| B. | 往容器内加入氧化铜粉末,若溶液变蓝色,则溶液一定有稀硫酸 | |
| C. | 往容器内加氯化钡溶液,如有沉淀生成,则溶液中一定有硫酸 | |
| D. | 将剩余固体加入到硫酸铜溶液中,如有红色固体生成,则溶液中没有硫酸. |
14.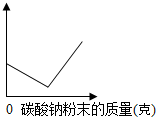 一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
 一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
一定质量的氢氧化钡溶液逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐标表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )| A. | 溶液中溶质的质量 | B. | 溶液中溶剂的质量 | ||
| C. | 生成沉淀的质量 | D. | 溶液的pH |
1.今年央视“3.15”晚会曝光了某些不法厂商制售劣质汽油的事件,劣质汽油中的甲缩醛(C3H8O2)等物质会损伤汽车并产生有害气体,下列关于甲缩醛的说法错误的是( )
| A. | 甲缩醛中的C、H元素的质量比为3:8 | |
| B. | 甲缩醛中含有氧分子 | |
| C. | 甲缩醛由3种元素组成 | |
| D. | 一个甲缩醛分子由3个碳原子、8个氢原子和2个氧原子构成 |