题目内容
10.已知:2NO+O2═2NO2,在一个密闭容器中,充入a个NO分子和b个O2分子,充分反应后,容器内氮原子个数和氧原子个数之比是( )| A. | $\frac{a}{2b}$ | B. | $\frac{a}{2(a+b)}$ | C. | $\frac{a}{b}$ | D. | $\frac{a}{(a+2b)}$ |
分析 在一个密闭容器中,充入a个NO分子和b个O2分子,则可知氮原子和氧原子的个数;在一定条件下充分反应后,根据质量守恒定律,则可知氮原子和氧原子的个数不变.故其个数之比也不会变化.
解答 解:
在一个密闭容器中,充入a个NO分子和b个O2分子,容器内氮原子个数和氧原子个数之比是$\frac{a}{a+2b}$,在一定条件下充分反应后,根据质量守恒定律,则可知氮原子和氧原子的个数不变.故其个数之比也不会变化,仍然为$\frac{a}{a+2b}$.
故选D.
点评 根据质量守恒定律的元素守恒,原子的个数在反应前后不变,来处理问题,考查了学生的分析和应变能力.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
20.下列图象能正确反应其对应关系的是( )
| A. |  向一定量PH=3的盐酸溶液中不断加水稀释 | |
| B. |  温度不变时,向一定量的饱和石灰水中不断加入生石灰 | |
| C. |  向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量 | |
| D. |  将一定质量的红磷放在盛有氧气的密闭容器中加热至燃烧 |
15.已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品.下列有关说法正确的是( )
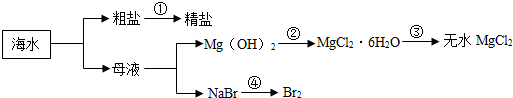
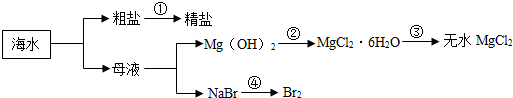
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:NaOH溶液、Na2CO3溶液、BaCl2溶液,过滤后加盐酸 | |
| B. | 第②步中加入的试剂为CaCl2溶液 | |
| C. | 第③步中发生氧化还原反应 | |
| D. | 在第④步中溴元素被还氧化 |
