题目内容
16.2015年8月12日,天津港某化工仓库发生爆炸,其中有一种有毒物质是氰化钠(化学式为NaCN),消防队员用过氧化氢溶液处理该有毒物质的化学方程式是:NaCN+H2O2+X═NaHCO3+NH3↑.(1)其中X的化学式为H2O,NaHCO3中C元素的化合价为+4价.
(2)过氧化氢常用作实验室制取氧气,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
分析 (1)根据质量守恒定律推断X的化学式,根据化合价原则,由化学式求出元素的化合价.
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,进行分析解答.
解答 解:(1)由质量守恒定律可知:反应前后元素的种类及数目不变,由反应NaCN+H2O2+X═NaHCO3+NH3↑,反应前后,原子种类、数目均不变,由反应的化学方程式NaCN+X+H2O═NaHCO3+NH3↑,反应前钠、碳、氮、氢、氧原子个数分别为1、1、1、2、2,反应后的生成物中钠、碳、氮、氢、氧原子个数分别为1、1、1、4、3,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则X为H2O;钠、氢显+1价,氧显-2价,根据化合物中各元素化合价代数和为零,则NaHCO3中C元素的化合价为+4;故答案为:H2O;+4.
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列实验操作中正确的是( )
| A. |  取用少量液体 | B. |  过滤 | C. |  闻气味 | D. |  稀释浓硫酸 |
4.向含有 AgNO3,Cu(NO3)2,Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是( )
| A. | 滤液中一定含 Ag+,Cu2+,Zn2+,Fe2+ | |
| B. | 滤液中一定含Fe2+,可能含Zn2+ | |
| C. | 滤液中一定含Zn2+、Fe2+,不含Ag+,、Cu2+ | |
| D. | 滤液中一定含Zn2+、Fe2+,可能含Cu2+ |
11.把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出,若放入FeSO4溶液中,无明显现象,则X、Ag、Fe三种金属活动性由强到弱的顺序正确的是( )
| A. | Fe、X、Cu | B. | X、Fe、Cu | C. | Fe、Cu、X | D. | Cu、X、Fe |
1.“防火胜于救火”,科学认识燃烧,增强安全防范意识是每个公民应具备的安全素养之一,下列说法错误的是( )
| A. | 身上着火不可乱跑,要就地打滚使火熄灭 | |
| B. | 水能灭火,是因为水能降低可燃物的着火点 | |
| C. | 对于不明原因引起的失火,不能贸然采取灭火措施 | |
| D. | 加油站等场所要严禁烟火,以避免爆炸的发生 |
8.我们每天生活在不断变化的物质世界里,下列生活里发生的变化属于物理变化的是( )
| A. | 牛奶变质 | B. | 活性炭吸附冰箱内的异味 | ||
| C. | 木材燃烧 | D. | 燃放烟花 |
5.空气中氧气含量测定的再认识.
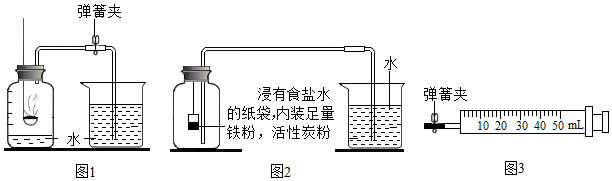
【实验回顾】如图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
①用弹簧夹夹紧橡皮管.
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧塞子.
③待装置冷却后打开弹簧夹.
④观察并记录水面的变化情况.
【实验反思】多次实验,反向集气瓶内上升的水的体积始终小于瓶内原空气体积的$\frac{1}{5}$.
【实验改进1】
I.根据铁在空气中生锈的原理(铁与氧气和水发生反应生成铁锈)设计图2实验装置,再次测定空气中氧气含量.装置中的食盐水和活性炭会加速铁生锈.
II.测得实验数据如下表
【交流表达】
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁,写出该反应的化学方程式2Fe+2H2O+O2=2Fe(OH)2,基本反应类型是化合反应.
(2)根据表数据计算,改进实验后测得的空气中氧气的体积分数是20.2%.(消耗的水的体积忽略不计,计算结果保留一位小数).
【猜想与假设】根据铁生锈的原理,某同学对最终生成的铁锈的好主意成分作出猜想:(Ⅰ)氧化铁(Ⅱ)碳酸铁,你认为猜想(Ⅱ)(填序号)一定是错误的,理由是化学反应前后元素种类不变.
【实验改进2】实验如图3装置进行实验.实验前应先进行的操作是检查装置的气密性.
【实验过程】步骤1:在注射器放入装有足量铁粉、活性炭粉的浸有食盐水的纸袋,封闭.
步骤2:打开弹簧夹,将活塞向右拉至一定距离,关闭弹簧夹.
步骤3:不断轻轻晃动注射器,至活塞位置不再发生变化.
【数据处理】实验中需要记录的数据是注射器中原来的空气体积,反应后剩余气体的体积.
计算得出氧气约占空气总体积的$\frac{1}{5}$.
【实验评价】与燃烧红磷法相比,用改进实验测定空气中氧气含量的优点是铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.
【实验回顾】如图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
①用弹簧夹夹紧橡皮管.
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧塞子.
③待装置冷却后打开弹簧夹.
④观察并记录水面的变化情况.
【实验反思】多次实验,反向集气瓶内上升的水的体积始终小于瓶内原空气体积的$\frac{1}{5}$.

【实验改进1】
I.根据铁在空气中生锈的原理(铁与氧气和水发生反应生成铁锈)设计图2实验装置,再次测定空气中氧气含量.装置中的食盐水和活性炭会加速铁生锈.
II.测得实验数据如下表
| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁,写出该反应的化学方程式2Fe+2H2O+O2=2Fe(OH)2,基本反应类型是化合反应.
(2)根据表数据计算,改进实验后测得的空气中氧气的体积分数是20.2%.(消耗的水的体积忽略不计,计算结果保留一位小数).
【猜想与假设】根据铁生锈的原理,某同学对最终生成的铁锈的好主意成分作出猜想:(Ⅰ)氧化铁(Ⅱ)碳酸铁,你认为猜想(Ⅱ)(填序号)一定是错误的,理由是化学反应前后元素种类不变.
【实验改进2】实验如图3装置进行实验.实验前应先进行的操作是检查装置的气密性.
【实验过程】步骤1:在注射器放入装有足量铁粉、活性炭粉的浸有食盐水的纸袋,封闭.
步骤2:打开弹簧夹,将活塞向右拉至一定距离,关闭弹簧夹.
步骤3:不断轻轻晃动注射器,至活塞位置不再发生变化.
【数据处理】实验中需要记录的数据是注射器中原来的空气体积,反应后剩余气体的体积.
计算得出氧气约占空气总体积的$\frac{1}{5}$.
【实验评价】与燃烧红磷法相比,用改进实验测定空气中氧气含量的优点是铁的缓慢氧化使集气瓶中的氧气消耗更为彻底,使实验结果更准确;测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.

 小琛在老师的指导下,测定某贝壳中碳酸钙的含量,她将足量质量分数为10%的稀盐酸加入到装有20g贝壳样品中,产生CO2气体的质量随时间的变化如图所示,请你计算:
小琛在老师的指导下,测定某贝壳中碳酸钙的含量,她将足量质量分数为10%的稀盐酸加入到装有20g贝壳样品中,产生CO2气体的质量随时间的变化如图所示,请你计算: