题目内容
18.回答下列问题:(1)澄清石灰水若敞口久置,观察到现象是产生白色沉淀.该反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.氢氧化钠露置在空气中不但能吸收水发生潮解,而且还能与空气中的二氧化碳反应而变质,因此氢氧化钠必须密封保存.写出氢氧化钠露置空气中变质的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
(2)为除去铁钉上的锈迹,某学生将带锈迹的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈黄色,这是因为(用化学方程式表示)Fe2O3+6HCl═2FeCl3+3H2O;不一会儿,又看到溶液中有气泡产生,这是因为(用化学方程式表示)Fe+2HCl═FeCl2+H2↑.
(3)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把浓硫酸慢慢注入水,并不断搅拌.
分析 根据氢氧化钠和氢氧化钙的性质以及盐酸的性质、浓硫酸稀释的方法、化学方程式的书写方法进行分析解答即可.
解答 解:(1)氢氧化钙能与空气中的二氧化碳反应生成碳酸钙沉淀,氢氧化钠固体易吸水潮解,能与二氧化碳反应生成碳酸钠和水而变质,故填:产生白色沉淀;Ca(OH)2+CO2═CaCO3↓+H2O;水;二氧化碳;2NaOH+CO2═Na2CO3+H2O;
(2)氧化铁能与盐酸反应生成氯化铁和水,氯化铁的水溶液为黄色,铁能与盐酸反应生成氯化亚铁和氢气,故填:黄;Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;
(3)稀释浓硫酸时,一定要把浓硫酸注入水中,故填:浓硫酸;水.
点评 本题考查的是常见的酸和碱的性质,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
12. A、B、C三种物质的溶解度曲线如图所示,下列分析不正确的是( )
A、B、C三种物质的溶解度曲线如图所示,下列分析不正确的是( )
 A、B、C三种物质的溶解度曲线如图所示,下列分析不正确的是( )
A、B、C三种物质的溶解度曲线如图所示,下列分析不正确的是( )| A. | t1℃时,A、C两种物质的饱和溶液中溶质的质量相等 | |
| B. | t2℃时,把50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3 | |
| C. | 将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数的大小关系是B>A>C | |
| D. | 将C的饱和溶液变为不饱和溶液,可采用降温的方法 |
 小红同学用如图总结了NaOH的四条化学性质.
小红同学用如图总结了NaOH的四条化学性质. 【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水;吸收CO2用浓NaOH溶液.
【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水;吸收CO2用浓NaOH溶液.
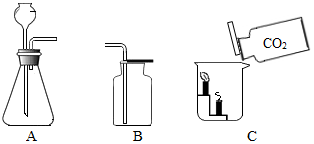 在实验室利用以下装置进行气体的制取和性质实验.
在实验室利用以下装置进行气体的制取和性质实验.