题目内容
2.同学们利用如图所示的装置,对质量守恒定律进行了谈究.实验结束后,老师另外提出了几个问题,请你一起参与思考.
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是B(选填“A”、“B”或“A和B”)
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红.根据上述已知条件,通过分析可以确定的是②④(选填序号)
①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?
分析 (1)根据反应产物进行分析解答;
(2)试管中滴入紫色石蕊试液变红,可知盐酸过量,碳酸钠全部反应,NaOH浓溶液质量增加0.22克,证明盐酸与碳酸钠反应生成了0.22g二氧化碳气体,根据二氧化碳的质量可计算碳酸钠的质量和生成的氯化钠的质量,进而求得原Na2CO3溶液的溶质质量分数和反应后试管中NaCl的溶质质量分数.
解答 解:(1)A中反应生成的五氧化二磷是固体,B中生成氢气,冷却至室温,B中气球仍胀大,故选B;
(2)试管中滴入紫色石蕊试液变红,可知盐酸过量,碳酸钠全部反应,NaOH浓溶液质量增加0.22克,证明盐酸与碳酸钠反应生成了0.22g二氧化碳气体,根据二氧化碳的质量可计算碳酸钠的质量和生成的氯化钠的质量,进而求得原Na2CO3溶液的溶质质量分数和反应后试管中NaCl的溶质质量分数,故选②④;
设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.22g
$\frac{106}{44}=\frac{x}{0.22g}$
x=0.53g
原Na2CO3溶液的溶质质量分数:$\frac{0.53g}{5g}×100%$=10.6%
答:原Na2CO3溶液的溶质质量分数为10.6%.
点评 本题难度不大,可依据已有的知识解答.

练习册系列答案
相关题目
11.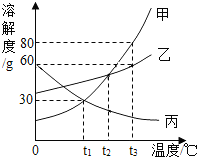 如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
 如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )| A. | 甲中混有少量杂质乙,可采用降温结晶的方法进行提纯 | |
| B. | t3℃时,将甲、丙的饱和溶液降温,甲溶液溶质的质量分数减小,丙不变 | |
| C. | t2℃时,甲、丙溶液中溶质的质量分数甲>丙 | |
| D. | t1℃时,60g水中溶解18g甲可得到其饱和溶液 |
16.四龙度假村位于甘肃省白银市东南25公里的黄河之滨,风景秀美,气候怡人.集休闲、度假、旅游、疗养、商务活动于一体,被誉为“陇上明珠”.牡丹园、芍药园、月季园,奇花异草,竞相争艳,在花开季节游客们能闻到花香味是因为( )
| A. | 分子很小 | B. | 分子可以再分 | ||
| C. | 分子之间有间隙 | D. | 分子在不断的运动 |

 化学反应常伴随能量变化,如图所示,在装有水的烧杯中放入一定质量的生石灰固体,反应片刻后可观察到玻璃管中的有色液体柱将上升(选填“上升”、“下降”或“不变”),请写出反应后所得溶液中溶质的化学式Ca(OH)2.
化学反应常伴随能量变化,如图所示,在装有水的烧杯中放入一定质量的生石灰固体,反应片刻后可观察到玻璃管中的有色液体柱将上升(选填“上升”、“下降”或“不变”),请写出反应后所得溶液中溶质的化学式Ca(OH)2. 小晨同学在研究二氧化碳气体的性质时,进行了如图所示的实验.
小晨同学在研究二氧化碳气体的性质时,进行了如图所示的实验.

