题目内容
9. 某公司生产出的纯碱产品中经检测只含有氯化钠杂质.在20℃时,称取26.5g该产品加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示.求:
某公司生产出的纯碱产品中经检测只含有氯化钠杂质.在20℃时,称取26.5g该产品加入到盛有一定质量稀盐酸的烧杯中,恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示.求:(1)生成CO2的质量=8.8g.
(2)反应后所得溶液的溶质质量分数.(精确到0.1%)
分析 反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钠的质量和反应生成的氯化钠质量,进一步可以计算完全反应后所得氯化钠溶液的溶质质量分数.
解答 解:(1)反应生成二氧化碳的质量为:172.5g-163.7g=8.8g,
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
x y 8.8g
$\frac{106}{x}=\frac{117}{y}=\frac{44}{8.8g}$
x=21.2g,y=23.4g,
完全反应后所得氯化钠溶液的溶质质量分数=$\frac{23.4g+(26.5g-23.4g)}{163.7g}$×100%=17.5%,
答案:
(1)8.8g
(2)完全反应后所得氯化钠溶液的溶质质量分数是17.5%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
19.除去粗盐中的难溶性杂质的主要步骤有:①过滤②蒸发③溶解.下列操作顺序正确的是( )
| A. | ①②③ | B. | ②③① | C. | ③①② | D. | ②①③ |
20.洁净的铁钉在下列情况中,锈蚀最快的是( )
| A. |  | B. |  | C. |  | D. |  |
17.分离、提纯是化学实验的重要环节,下列设计不能达到实验目的是( )
| 选项 | 物质 | 杂质 | 试剂或方法 |
| A | NaCl 固体 | 泥沙 | 加水溶解、过滤、蒸发 |
| B | KCl 溶液 | K2SO4 | 滴加足量Ba(NO3)2溶液并过滤 |
| C | KNO3溶液 | Ba(NO3)2 | 滴加适量K2SO4溶液、过滤 |
| D | N2 | O2 | 通过红热的铜丝 |
| A. | A | B. | B | C. | C | D. | D |
4.工业上利用乙炔(C2H2)产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:
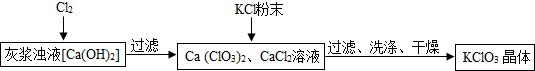
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是相同温度下,氯酸钾的溶解度小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):
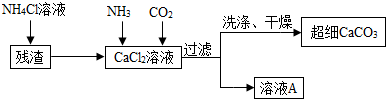
(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaClO3 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):

(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
1. 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )| A. | 红磷熄灭后应立刻打开弹簧夹 | |
| B. | 点燃红磷前先用弹簧夹夹紧橡皮管 | |
| C. | 最终瓶中剩余的气体主要是氮气 | |
| D. | 实验时,只取用极少量红磷,可减少污染且不影响实验结果 |
7.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料.他们既有相似之处,又有不同之点.下列说法不正确的是( )
| A. | 它们水溶液的pH都小于7 | |
| B. | 它们都可用于除铁锈 | |
| C. | 它们都能与碱反应生成盐和水 | |
| D. | 打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口都出现白雾 |