题目内容
17. 现称取碳酸钠样品6g,配制成溶液,再向其中加入CaCl2溶液,反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:
现称取碳酸钠样品6g,配制成溶液,再向其中加入CaCl2溶液,反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:(1)恰好完全反应时烧杯中溶液的pH=7(选填“>”、“<”或“=”);
(2)计算碳酸钠在样品中的质量分数.(写出计算过程,计算结果保留一位小数).
分析 (1)碳酸钠与氯化钙反应会生成碳酸钙沉淀和氯化钠,恰好完全反应时烧杯中溶液呈中性,pH=7;
(2)利用碳酸钙的质量可求碳酸钠的质量,进而求出质量分数.
解答 解:(1)碳酸钠与氯化钙反应会生成碳酸钙沉淀和氯化钠,恰好完全反应时烧杯中溶液呈中性,pH=7;
(2)设碳酸钠的质量为x
Na2C03+CaCl2=CaC03↓+2NaCl
106 100
x 5g
$\frac{106}{100}=\frac{x}{5g}$
x=5.3g
碳酸钠在样品中的质量分数:$\frac{5.3g}{6g}×100%$=88.3%
答:碳酸钠在样品中的质量分数为88.3%.
点评 此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用图象的分析求出生成的碳酸钙的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.

练习册系列答案
相关题目
7.下列说法不正确的是( )
| A. | 浓硫酸具有吸水性,所以可以做某些气体的干燥剂 | |
| B. | 患胃酸过多症的病人可口服含有NaHCO3或Al(OH)3的药物缓解胃酸过多 | |
| C. | 酸碱生成盐和水的反应,既是中和反应,又属复分解反应 | |
| D. | 稀释浓硫酸时一定要将水慢慢注入浓硫酸中 |
5.写出下列符号(或名称)
| 名称 | 锂 | 氢 | 磷 | 镁 | 铝 | 锌 | |
| 元素符号 | Ca | ||||||
| 名称 | 氮 | 钾 | 氯 | 氩 | 铁 | ||
| 元素符号 | S | Na |
12.加热10g高锰酸钾一段时间后,停止加热,称量剩余固体的质量为9.2g.那么剩余固体的成分是( )
| A. | K2MnO4、MnO2 | B. | KMnO4、MnO2 | ||
| C. | KMnO4、K2MnO4、MnO2 | D. | KMnO4、K2MnO4 |
6.如图实验操作正确的是( )
| A. |  振荡试管 | B. |  稀释浓硫酸 | C. |  加热液体 | D. |  量取液体 |
7.能说明镁条燃烧是化学变化的实验现象是( )
| A. | 发出耀眼的白光 | B. | 放出大量的热量 | ||
| C. | 打磨后镁条变亮 | D. | 生成不同于镁条的白色粉末 |
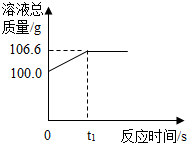 为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.