题目内容
15.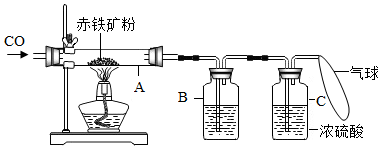 钢铁产生是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)
钢铁产生是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)(1)甲组同学称取一定质量的赤铁粉,采用如图的装置进行实验.
①装置A中发生反应的化学方程式是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是氢氧化钠浓溶液.
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
方法一:称量反应前后A装置的总质量,计算出F2O3的含量;
方法二:称量反应前后B装置的总质量,得出反应生成的CO2质量,计算出Fe2O3的含量.
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应,过滤(填一个操作名称)后立即称量.根据称量的数据计算出Fe2O3的含量.
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价.
| 方案 | 优点 |
| 甲组 | 可以用两种方法计算Fe2O3的含量 |
| 乙组 | 不用加热,节能环保且操作简单,安全系数高 |
分析 (1)①根据一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳进行分析;
②根据氢氧化钠溶液能够较好的吸收二氧化碳进行分析;
③从二氧化碳能被B装置中的溶液完全吸收考虑;
(2)可用过滤的方法得到残渣,然后称量其质量,然后通过计算得到Fe2O3的含量;
(3)根据甲、乙各自的过程对比判断各自的优点.
解答 解:(1)①一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学反应式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
②氢氧化钠溶液可以很好的吸收二氧化碳气体,所以要充分吸收反应生成的CO2,装置B中应盛放的试剂是NaOH溶液;
③因二氧化碳已被B装置完全吸收,所以可以通过称量反应前后B装置的总质量,得出反应生成的CO2质量,然后根据化学反应式计算出Fe2O3的含量;
(2)向烧杯中加入过量的稀硫酸充分反应后,我们可以用过滤的方法取出残渣,然后通过称量残渣的质量得出Fe2O3的含量;
(3)通过两组的对比可知,甲组的优点:可以用两种方法计算Fe2O3的含量;乙组的优点:不用加热,节能环保且操作简单,安全系数高.
故答案为:(1)①Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
②NaOH;
③反应前后B装置的总质量;
(2)过滤;
(3)甲组:可以用两种方法计算Fe2O3的含量;
乙组:不用加热,节能环保且操作简单,安全系数高.
点评 本题通过一氧化碳还原氧化铁的实验,考查学生的化学反应式的书写及相关计算和实验的设计,要同学们具有综合的化学知识.

练习册系列答案
相关题目
6.下列变化属于化学变化的是( )
| A. | 佛山剪纸 | B. | 佛山陶瓷 | C. | 石蜡熔化 | D. | 酒精挥发 |
3.课本上有8个“基础实验”,以提升同学们的实验能力,以下叙述正确的是( )
| A. | “酸与碱的化学性质”实验中,将实验废液直接倒入下水道 | |
| B. | “溶液的酸碱度”实验中,将pH试纸伸入溶液中测定酸碱度 | |
| C. | “二氧化碳的实验室制取与性质”实验中,用浓盐酸代替稀盐酸 | |
| D. | “粗盐中难溶性杂质的去除”实验中,当蒸发皿中出现较多固体时停止加热 |
10.20℃时,100g水中最多溶解0.3g A物质,则A在水中的溶解性为( )
| A. | 易溶 | B. | 可溶 | C. | 微溶 | D. | 难溶 |
 请阅读下面科普材料,然后回答问题.
请阅读下面科普材料,然后回答问题. ,而Vantablack实际上是只有一个原子厚的碳钠米管层,他可吸收99.965%的可见光,有人看过之后说:“我的眼睛都没法聚焦了,他太黑了,根本看不到任何细节,几乎就像是个黑洞,吸走了所有光线.”它让这张图中起皱的锡纸看起来就像兔八哥卡通片中的便携洞穴,这种材料可用于望远镜、卫星上的星体跟踪定位器等.
,而Vantablack实际上是只有一个原子厚的碳钠米管层,他可吸收99.965%的可见光,有人看过之后说:“我的眼睛都没法聚焦了,他太黑了,根本看不到任何细节,几乎就像是个黑洞,吸走了所有光线.”它让这张图中起皱的锡纸看起来就像兔八哥卡通片中的便携洞穴,这种材料可用于望远镜、卫星上的星体跟踪定位器等.
