题目内容
20.元素周期表是学习和研究化学的重要工具,每个横行代表一个周期.,请按表中信息填空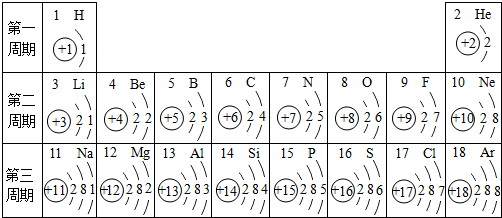
(1)查找出原子序数为11号元素的名称钠,该元素的原子在化学反应中易失去(填得到或失去),它与地壳中含量最高的元素结合形成的化合物的化学式为Na2O
(2)核电荷数为12的离子结构示意图
 ,离子符号为Mg2+
,离子符号为Mg2+(3)从上表可发现的规律是(写一条即可)每一横行元素从左向右质子数递增
(4)硫元素的原子结构示意图为
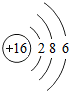 写出它的离子符号S2-,该元素的原子核外有3个电子层,它属于非金属元素(“金属”、“非金属”),其化学性质比较活泼,在化学反应中易得到(填“得到”、“失去”)电子.
写出它的离子符号S2-,该元素的原子核外有3个电子层,它属于非金属元素(“金属”、“非金属”),其化学性质比较活泼,在化学反应中易得到(填“得到”、“失去”)电子.
分析 (1)根据原子序数=核电荷数=质子数,由元素周期表中原子结构示意图的核内质子数进行分析解答;若最外层电子数≥4,则一般为非金属元素,在化学反应中易得电子,若最外层电子数<4,则一般为金属元素,在化学反应中易失去电子.结合化学式的写法来分析;
(2)根据离子符号的书写方法以及离子结构示意图的画法来分析;
(3)根据元素周期表中每一横行元素从左向右排列时数字的变化及数字的意义来分析解答.
(4)根据原子结构示意图的意义来分析.
解答 解:(1)11号元素是钠元素,其原子核外最外层有1个电子,在化学反应中易失去一个电子而显+1价,地壳中含量最多的元素是氧元素,通常显-2价,二者组成的化合物氧化钠的化学式为Na2O;故填:钠;失去;Na2O;
(2)镁原子最外层有2个电子,在化学反应中易失去2个电子而形成2、8结构的镁离子,带两个单位的正电荷;故填: ;Mg2+;
;Mg2+;
(3)因周期表中元素符号前的数字为原子序数,也是原子的质子数,由元素周期表中每一横行元素从左向右排列可发现质子数在依次增大,故填:每一横行元素从左向右质子数递增.
(4)硫元素是16号元素,质子数为16,核外电子排布为:2、8、6结构,原子结构示意图为: ;最外层有6个电子,在化学反应中易得到2个电子而带上2个单位的负电荷形成硫离子;属于非金属元素,故填:
;最外层有6个电子,在化学反应中易得到2个电子而带上2个单位的负电荷形成硫离子;属于非金属元素,故填: ;S2-;3;非金属;得到.
;S2-;3;非金属;得到.
点评 本题考查元素周期律的实质,明确原子的结构与性质的关系、元素的性质有哪些是解答的关键,并注意不能用元素本身的性质来解释元素性质的周期性变化.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
10.下列变化属于化学变化的是( )
| A. | 高锰酸钾溶解于水 | B. | 洗涤剂清洗餐具上的油污 | ||
| C. | 饱和石灰水升温后变浑浊 | D. | 氢氧化钠清洗炉具中的油污 |
5.将含泥沙的粗盐提纯,并用制得的精盐配制80g10%的食盐溶液.下列说法错误的是( )
| A. | 过滤操作时,搅拌漏斗中的液体,可以加快过滤的速度 | |
| B. | 配制时需用的主要仪器有:天平、药匙、量筒、胶头滴管、烧杯、玻璃棒 | |
| C. | 配制溶液的步骤是:计算、称量、溶解、转移装瓶、贴标签 | |
| D. | 蒸发滤液时,不断用玻璃棒搅拌,防止液体溅出 |
12. 按右图所示装置进行实验(图中铁架台均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅰ有气泡生成,液体从Ⅰ中沿着导管进入Ⅱ中,Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )
按右图所示装置进行实验(图中铁架台均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅰ有气泡生成,液体从Ⅰ中沿着导管进入Ⅱ中,Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )
 按右图所示装置进行实验(图中铁架台均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅰ有气泡生成,液体从Ⅰ中沿着导管进入Ⅱ中,Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )
按右图所示装置进行实验(图中铁架台均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅰ有气泡生成,液体从Ⅰ中沿着导管进入Ⅱ中,Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )| A | 甲:NaHCO3、稀HCl;乙:NaOH溶液 | B | 甲:Al,稀H2SO4;乙:Ba(NO3)2溶液 |
| C | 甲:MgO,稀盐酸;乙:AgNO3溶液 | D | 甲:Cu、稀H2SO4;乙:BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
9.盐在生活中是用途非常广泛的一类物质.下列说法正确的是( )
| A. | 添加大量的亚硝酸钠来保鲜食品 | |
| B. | 硝酸钾在农业上可用作复合肥 | |
| C. | 用硫酸铜配制的波尔多液可以保存在铁桶中 | |
| D. | 用纯碱除去面粉发酵中生成的有机酸,利用了中和反应 |

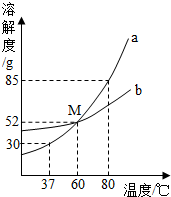 如图为a、b两种物质的溶解度曲线.请根据图中内 容 回答下列问题:
如图为a、b两种物质的溶解度曲线.请根据图中内 容 回答下列问题: