题目内容
2.某补钙剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与50g盐酸混合(药剂中其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为65.6g.
(1)该品牌补钙剂每片含CaCO3的质量为多少?
(2)所用盐酸中溶质的质量分数是多少?
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应前后的质量差即为反应生成二氧化碳质量,根据二氧化碳质量可以计算碳酸钙质量和反应的氯化氢质量,进一步可以计算该品牌补钙剂每片含CaCO3的质量、所用盐酸中溶质的质量分数.
解答 解:(1)设反应的碳酸钙质量为x,反应的氯化氢质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 44
x y 20g+50g-65.6g
$\frac{100}{x}$=$\frac{73}{y}$=$\frac{44}{20g+50g-65.6g}$,
x=10g,y=7.3g,
该品牌补钙剂每片含CaCO3的质量为:10g÷20=0.5g,
答:该品牌补钙剂每片含CaCO3的质量为0.5g.
(2)所用盐酸中溶质的质量分数是:$\frac{7.3g}{50g}$×100%=14.6%,
答:所用盐酸中溶质的质量分数是14.6%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
13.下列关于实验及现象描述正确的是( )
| A. | 将细铁丝放入氧气中,火星四射,生成一种黑色固体 | |
| B. | CO在空气中燃烧,发出淡蓝色火焰,放出热量 | |
| C. | 向盛有铝片的试管中加入稀盐酸,溶液由无色变成浅绿色 | |
| D. | 将红色的铜丝在酒精灯火焰上加热,会变成黑色 |
10.下列化学方程式中书写正确的是( )
| A. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 | B. | Al+H2SO4═AlSO4+H2↑ | ||
| C. | 2NaOH+BaCl2═Ba(OH)2+2NaCl↓ | D. | Cu+FeSO4═Fe+CuSO4 |
17.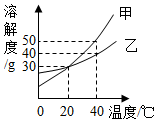 甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
 甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,分别在100g水中加入40g甲、乙,充分溶解后,所得溶液中溶质的质量分数相等 | |
| C. | 20℃时,甲物质和乙物质的溶液中溶质的质量分数一定相等 | |
| D. | 分别将40℃的甲物质和乙物质的饱和溶液降温到20℃,甲析出晶体量一定大于乙 |
14.与铝元素的化学性质关系最密切的是( )
| A. | 铝原子的核外电子数 | B. | 铝原子最外层电子数 | ||
| C. | 铝元素的相对原子质量 | D. | 铝元素的核电荷数 |
15.下列有关化学用语中数字“2”的意义的说法,错误的是( )
①SO2 ②Mg2+ ③CO2 ④$\stackrel{+2}{Cu}$SO4 ⑤O2- ⑥H2O2 ⑦2O.
①SO2 ②Mg2+ ③CO2 ④$\stackrel{+2}{Cu}$SO4 ⑤O2- ⑥H2O2 ⑦2O.
| A. | 表示分子个数的是⑦ | |
| B. | 表示离子所带电荷数的是②⑤ | |
| C. | 表示化合价数值的是④ | |
| D. | 表示一个分子中含有某种原子个数的是①③⑥ |
16.下列图象能正确反映对应变化关系的是( )
| A. |  加热一定质量的高锰酸钾固体 | |
| B. |  一定量的稀硫酸中滴加氢氧化钠溶液至过量 | |
| C. |  一定温度下,向饱和硝酸钾溶液中不断加入硝酸钾固体,充分搅拌 | |
| D. |  分别向同质量、同质量分数的稀盐酸中不断加入碳酸钙和氧化钙固体 |
 ,图中“
,图中“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子,根据图示回答:
”表示氢原子,根据图示回答: