题目内容
(2012?陵县二模)如图是“×××钙片商品标签图”| ×××儿童咀嚼片 (60片装) |
| [主要成分]碳酸钙,维生素D [规格]2.5g/片,每片中含碳酸钙≥1.24g,维生素D 100l.U. [食用方法]嚼食,每天一片 [功效]补钙 |
(1)主要成分碳酸钙中钙元素的质量分数为______,每片中至少含钙元素的质量为______g.
(2)小红同学为测定其碳酸钙的含量标注是否属实,她取出4片钙片,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g.称量烧杯中剩余物为47.8g(不含烧杯质量,假定钙片其他成分不与稀盐酸反应).
试计算:①生成二氧化碳的质量______;
②稀盐酸中溶质的质量分数______;
③通过计算判断钙片中碳酸钙的含量标注是否属实______.
【答案】分析:(1)根据碳酸钙的化学式,可计算碳酸钙中钙元素的质量分数;由标签标注每片中碳酸钙的含量,利用碳酸钙中钙元素质量分数,计算每片含钙元素质量;
(2)利用质量守恒定律,由反应前后质量差求出反应放出二氧化碳的质量,根据反应的化学方程式,计算所用稀盐酸中溶质质量及所取钙片中碳酸钙质量,然后分别求出稀盐酸中溶质的质量分数、钙片中碳酸钙的含量,与标签中含量进行对比,判断标注是否属实.
解答:解:(1)碳酸钙CaCO3中钙元素的质量分数=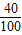 ×100%=40%,每片中至少含钙元素的质量=1.24g×40%=0.5g;
×100%=40%,每片中至少含钙元素的质量=1.24g×40%=0.5g;
(2)根据质量守恒定律可知.生成二氧化碳的质量为:2.5g×4+40.0g-47.8g=2.2g
设参加反应的碳酸钙的质量为x,HCl的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 2.2g
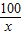 =
=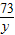 =
=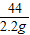
x=5g,y=3.65g
稀盐酸中溶质的质量分数=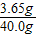 ×100%=9.1%
×100%=9.1%
钙片中碳酸钙的含量=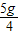 =1.25g>1.24g,钙片中碳酸钙的含量标注属实
=1.25g>1.24g,钙片中碳酸钙的含量标注属实
故答案为:
(1)40%;0.5;
(2)①2.2g;②9.1%;③标注属实.
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.
(2)利用质量守恒定律,由反应前后质量差求出反应放出二氧化碳的质量,根据反应的化学方程式,计算所用稀盐酸中溶质质量及所取钙片中碳酸钙质量,然后分别求出稀盐酸中溶质的质量分数、钙片中碳酸钙的含量,与标签中含量进行对比,判断标注是否属实.
解答:解:(1)碳酸钙CaCO3中钙元素的质量分数=
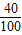 ×100%=40%,每片中至少含钙元素的质量=1.24g×40%=0.5g;
×100%=40%,每片中至少含钙元素的质量=1.24g×40%=0.5g;(2)根据质量守恒定律可知.生成二氧化碳的质量为:2.5g×4+40.0g-47.8g=2.2g
设参加反应的碳酸钙的质量为x,HCl的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 2.2g
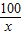 =
=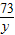 =
=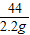
x=5g,y=3.65g
稀盐酸中溶质的质量分数=
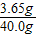 ×100%=9.1%
×100%=9.1%钙片中碳酸钙的含量=
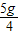 =1.25g>1.24g,钙片中碳酸钙的含量标注属实
=1.25g>1.24g,钙片中碳酸钙的含量标注属实故答案为:
(1)40%;0.5;
(2)①2.2g;②9.1%;③标注属实.
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2012?陵县二模)某石灰厂新到一批石灰石,其中含有杂质二氧化硅(二氧化硅不溶于水,不溶
于盐酸,高温不分解).为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组
实验,测得数据如表:
(1)在空格中填写数据
(2)该实验中,第______(填数字)组同学的实验中,稀盐酸一定反应完全;第三组实验中,______一定有剩余.
(3)求出该石灰石样品的纯度______.
于盐酸,高温不分解).为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组
实验,测得数据如表:
| 实验次数 | 1 | 2 | 3 |
| 稀盐酸质量(g) | 50 | 50 | 100 |
| 样品质量(g) | 20 | 30 | 20 |
| 剩余物质质量(g) | 63.4 | 73.4 | 113.4 |
| 产生气体的质量(g) | 6.6 | 6.6 | ______ |
(2)该实验中,第______(填数字)组同学的实验中,稀盐酸一定反应完全;第三组实验中,______一定有剩余.
(3)求出该石灰石样品的纯度______.
 (2012?陵县二模)如图所示,一物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤示数变化情况(填“变大”、“不变”或“变小”):
(2012?陵县二模)如图所示,一物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤示数变化情况(填“变大”、“不变”或“变小”):