题目内容
7.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
请回答:
(1)固体B的化学式Fe;
(2)滤液A和滤液B含有相同的溶质是硫酸锌或ZnSO4;
(3)写出步骤④发生反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
分析 在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,铁能被磁铁吸引,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离.
解答 解:(1)废液中含有硫酸铜、硫酸锌和硫酸亚铁,加入的过量锌粉与硫酸铜和硫酸亚铁反应生成硫酸锌,固体A中含有铁、铜和锌,铁能被磁铁吸引,所得的固体B为铁;
(2)过量锌粉与硫酸铜和硫酸亚铁反应生成硫酸锌,因此滤液中含有硫酸锌;固体C中含有铜和锌,剩余的锌与硫酸反应生成硫酸锌,因此利用B中含有硫酸锌,则利用A和利用B含有相同的溶质是硫酸锌;
(3)固体C中含有铜和锌,剩余的锌与硫酸反应生成硫酸锌和氢气,所以本题答案为:Zn+H2SO4=ZnSO4+H2↑.
故答案为:(1)Fe;(2)硫酸锌或ZnSO4;(3)Zn+H2SO4=ZnSO4+H2↑.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目
17.以下是一个化学反应的微观示意图.从该示意图中获取的信息正确的是( )


| A. | 反应前后元素种类发生改变 | |
| B. | 该反应的基本类型是化合反应 | |
| C. | 反应前后分子种类不发生改变 | |
| D. | 参加反应的两种分子的个数比是1:2 |
18.“改善环境质量,建设美丽泉港”是我们共同的责任,下列做法不利于保护环境的是( )
| A. | 推广秸秆综合利用杜绝露天焚烧 | B. | 推广使用一次性塑料餐盒 | ||
| C. | 工业废水处理达标后排放 | D. | 乘坐公共交通工具 |
19.下列四个图象分别对应四种操作过程,其中不正确的是( )
| A. | 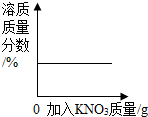 向饱和KNO3溶液中加入KNO3 | |
| B. | 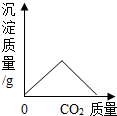 向CaCl2溶液中通入CO2 | |
| C. | 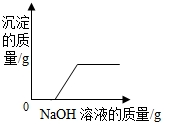 向CuCl2和HCl的混合溶液中加入过量NaOH溶液 | |
| D. | 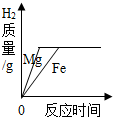 向两份同体积和同质量分数的HCl溶液中分别加入足量的铁粉和镁粉 |

 如图所示,各连线两端物质相互都能发生反应,试推断X可能是C
如图所示,各连线两端物质相互都能发生反应,试推断X可能是C