题目内容
13.下列字母A~H表示初中化学常见的物质,它们由氢、碳、氧、氯、钠、钙、铁中的2~3种元素组成.(1)A、B常温下均为液体,A分解可得到B和一种能使带火星木条复燃的气体.则该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)C、D、E均由两种元素组成,其中C与D溶液反应得到黄色溶液;C与E在高温下反应生成一种单质和一种化合物F,E、F组成元素相同.
①C与D反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O.
②C与E反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)向无色的G的溶液中滴加几滴无色酚酞溶液变红,再向其中滴加H的溶液产生白色沉淀、溶液仍呈红色,然后加入过量的D的溶液,沉淀消失产生气泡并得到无色溶液.
①用化学方程式解释产生白色沉淀的原因Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
②最终得到的无色溶液中的溶质为NaCl、CaCl2、HCl.
分析 (1)A、B常温下均为液体,A分解可得到B和一种能使带火星木条复燃的气体,因此A是过氧化氢,过氧化氢分解产生水和氧气;
(2)C、D、E均由两种元素组成,其中C与D溶液反应得到黄色溶液,因此是盐酸和氧化铁反应产生氯化铁和水;C与E在高温下反应生成一种单质和一种化合物F,E、F组成元素相同,因此可以是一氧化碳和氧化铁反应产生二氧化碳,因此C是氧化铁,D是盐酸,E是一氧化碳;
(3)向无色的G的溶液中滴加几滴无色酚酞溶液变红,因此G溶液显碱性;再向其中滴加H的溶液产生白色沉淀、溶液仍呈红色,然后加入过量的D-盐酸的溶液,沉淀消失产生气泡并得到无色溶液,因此H是氢氧化钙,反应产生氢氧化钠和碳酸钙沉淀,碳酸钙和过量的盐酸反应产生二氧化碳,据此完成相关的问题.
解答 解:(1)A、B常温下均为液体,A分解可得到B和一种能使带火星木条复燃的气体,因此A是过氧化氢,过氧化氢分解产生水和氧气;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)C、D、E均由两种元素组成,其中C与D溶液反应得到黄色溶液,因此是盐酸和氧化铁反应产生氯化铁和水;C与E在高温下反应生成一种单质和一种化合物F,E、F组成元素相同,因此可以是一氧化碳和氧化铁反应产生二氧化碳,因此C是氧化铁,D是盐酸,E是一氧化碳;故填:Fe2O3+6HCl═2FeCl3+3H2O;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)向无色的G的溶液中滴加几滴无色酚酞溶液变红,因此G溶液显碱性;再向其中滴加H的溶液产生白色沉淀、溶液仍呈红色,然后加入过量的D-盐酸的溶液,沉淀消失产生气泡并得到无色溶液,因此H是氢氧化钙,反应产生氢氧化钠和碳酸钙沉淀,碳酸钙和过量的盐酸反应产生二氧化碳、氯化钙和水,盐酸还与氢氧化钠反应产生氯化钠,因此溶质有氯化钙、氯化钠及盐酸;故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;NaCl、CaCl2、HCl.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

| A. | 一氧化碳可以冶炼金属,是由于一氧化碳具有可燃性 | |
| B. | 工业上常用稀硫酸除去铁锈,是由于稀硫酸能与铁反应 | |
| C. | 洗涤剂常用来洗涤油污,是因为洗涤剂有乳化功能 | |
| D. | 稀有气体中的氦可用于填充气球,是由于氦的化学性质不活泼 |
 同学们发现将NaOH溶液和稀盐酸混合后没有明显现象,为了证明NaOH能与HCl发生中和反应,设计了如下实验:
同学们发现将NaOH溶液和稀盐酸混合后没有明显现象,为了证明NaOH能与HCl发生中和反应,设计了如下实验:| 实验步骤 | 现象 | 结论 |
| 实验1.取少量NaOH溶液于试管中,向其中滴加几滴无色酚酞试液,振荡. | 溶液呈红色 | |
| 实验2.向实验1的试管中加入适量的稀盐酸,振荡. | 红色逐渐消失. | NaOH与HCl能反应. |
【反思与评价】同学们对实验2反应后所得溶液的酸碱性进行讨论,小玲同学认为呈碱性,小生同学认为呈中性,小柏同学认为也可能呈酸性,最后同学们否定了小玲同学的说法,其理由是红色逐渐消失;欲进一步确定实验2反应后所得溶液的酸碱性,其操作是用试管取少量所得溶液,滴入1-2滴紫色石蕊试液,振荡.
| A. | 所有溶液中的溶剂均为水 | |
| B. | 受热时水分子的体积逐渐变大 | |
| C. | 衣服晒干过程中水分子分解为气体 | |
| D. | 与肥皂水混合能产生大量泡沫的是软水 |
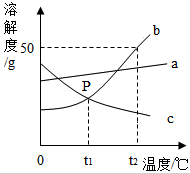 根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据图中a、b、c三种物质的溶解度曲线,回答下列问题: