题目内容
16.学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,所以镁着火不能用CO2来灭火,但没有找到有关Na能否与CO2反应的介绍.于是同学们展开了钠着火能否用CO2来灭火的探究.【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程式为4Na+CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2O+C.
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧.进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,Na2O+CO2═Na2CO3↑;
②Na2CO3的存在会干扰NaOH的检测.
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C;②Na2CO3;、C;③NaOH、C;④Na2O、Na2CO3、C
通过理论分析,猜想③(填序号)肯定错误的,理由是NaOH中有氢元素而反应物中没有氢元素,根据质量守恒定律可知③错误.
【验证猜想】
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有C |
| (2) | 取少量(1)所得上层溶液,加入过量的CaCl2溶液 | 有白色沉淀生成 | 燃烧产物中肯定有Na2CO3 |
| (3) | 取少量(2)所得上层清液,加入CuSO4(或CuCl2) | 溶液变红 | 燃烧产物中肯定有Na2O |
【结论】猜想④(填序号)是正确的.
分析 【提出猜想】钠能发生类似于CO2与镁的反应,用类比的方法可书写其发生的化学方程式;
【实验】根据资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出几种猜想;通过质量守恒定律可知分析,猜想③肯定是错误的;
【验证猜想】
由操作和现象,得出结论;或由操作和结论,推测现象;或由现象和结论,推测操作.了解在步骤(2)中CaCl2溶液为什么要加入至过量的原因.
【结论】由猜想得结论.
解答 解:【提出猜想】钠能发生类似于CO2与镁的反应,故可用类比的方法书写其发生的化学方程式为:4Na+CO2 $\frac{\underline{\;点燃\;}}{\;}$2Na2O+C.
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧.
进一步查阅资料得知:①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH.②Ca(OH)2溶于水而CaCO3不溶于水.③Na2CO3的存在会干扰NaOH的检测.基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:①Na2O、C;②Na2CO3、C;③NaOH、C;④Na2O、Na2CO3、C;
通过理论分析,猜想:③肯定是错误的,理由是:NaOH中有氢元素而反应物中没有氢元素,根据质量守恒定律可知③错误.
【验证猜想】由操作和现象,得出结论;或由操作和结论,推测现象;或由现象和结论,推测操作:故
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管 底部有黑色固体 | 燃烧产物中肯定有C(炭) |
| (2) | 取(1)所得少量上层清液,加入过量的CaCl2溶液 | 有白色沉淀生成 | 燃烧产物中肯定有Na2CO3 |
| (3) | 取(2)所得少量上层清液,加入 CuSO4(或CuCl2)溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有 Na2O |
【结论】通过实验验证可知猜想Ⅳ正确.
故答案为:【提出猜想】4Na+CO2 $\frac{\underline{\;点燃\;}}{\;}$2Na2O+C;
【实验】Na2CO3;③;NaOH中有氢元素而反应物中没有氢元素,根据质量守恒定律可知③错误;
【验证猜想】
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | |||
| (2) | 有白色沉淀生成 | ||
| (3) | CuSO4(或CuCl2) | Na2O |
【结论】④.
点评 掌握质量守恒定律的也是守恒的思想处理问题;了解物质的鉴别与推断的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱为原材料制取烧碱,其制取流程如图:

(1)写出加入纯碱溶液后发生反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)[问题与发现]固体A是纯净的氢氧化钠吗?
[猜想与假设]根据反应原理,同学们提出以下猜想:
甲的猜想:A是纯净的氢氧化钠固体.
乙的猜想:A是氢氧化钠和氢氧化钙的混合物.
你的猜想:氢氧化钠和碳酸钠的混合物.
[实验验证]
[反思与评价]同学们讨论后,认为甲的结论不一定成立,原因是因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)写出加入纯碱溶液后发生反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)[问题与发现]固体A是纯净的氢氧化钠吗?
[猜想与假设]根据反应原理,同学们提出以下猜想:
甲的猜想:A是纯净的氢氧化钠固体.
乙的猜想:A是氢氧化钠和氢氧化钙的混合物.
你的猜想:氢氧化钠和碳酸钠的混合物.
[实验验证]
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体A,用适量水溶解后,滴加几滴无色酚酞溶液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体A,用适量水溶解后,滴加几滴饱和碳酸钠溶液 | 没有出现白色沉淀 | 猜想不成立 |
| 你 | 取少量固体A,溶于适量水形成溶液后,滴加足量的稀盐酸 | 有气泡产生 | 猜想成立 |
7.下列观察硫酸铜变化的实验中,没有发生化学变化的是( )
| A. | 向盛有硫酸铜晶体的试管中加水,观察晶体的溶解情况 | |
| B. | 在硫酸铜溶液中滴加氢氧化钠溶液,观察溶液的变化 | |
| C. | 加热试管中的一块硫酸铜晶体,观察晶体的变化 | |
| D. | 在硫酸铜粉末中逐滴加入水,观察发生的现象 |
4.
| 物质名称 | 氧化铜 | 氮气 | 氧化镁 | ||
| 化学式 | ZnCl2 | P2O5 |
11.下列实验设计不能达到实验目的是( )
| A. | 加入过量稀盐酸除去氢氧化钠溶液中混有的少量碳酸钠 | |
| B. | 用高温煅烧的方法除去生石灰中的石灰石 | |
| C. | 加入熟石灰,然后用研磨的方法鉴别氯化钾与氯化铵固体 | |
| D. | 用水鉴别碳酸钙和氢氧化钠两种粉末状固体 |
8.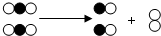 如图是表示物质间发生的一种化学反应模型示意图,图中“
如图是表示物质间发生的一种化学反应模型示意图,图中“ 、
、 ”分别表示两种不同元素的原子.该反应的类型属于( )
”分别表示两种不同元素的原子.该反应的类型属于( )
 如图是表示物质间发生的一种化学反应模型示意图,图中“
如图是表示物质间发生的一种化学反应模型示意图,图中“ 、
、 ”分别表示两种不同元素的原子.该反应的类型属于( )
”分别表示两种不同元素的原子.该反应的类型属于( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
5.(1)下列做法应该提倡的是ABCD.
A.垃圾分类 B.减少使用一次性餐具 C.使用可降解的塑料袋 D.淘米水浇花
(2)天然气(主要成分为甲烷)是家用燃料.甲烷在空气中燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.根据下表数据分析,与煤(按C计)相比,用天然气做燃料的优点是燃烧相同质量的两种物质,甲烷产生的二氧化碳少,对环境污染小、放出的热量多.
A.垃圾分类 B.减少使用一次性餐具 C.使用可降解的塑料袋 D.淘米水浇花
(2)天然气(主要成分为甲烷)是家用燃料.甲烷在空气中燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.根据下表数据分析,与煤(按C计)相比,用天然气做燃料的优点是燃烧相同质量的两种物质,甲烷产生的二氧化碳少,对环境污染小、放出的热量多.
| 1g物质完全燃烧产生CO2的质量 | 1g物质完全燃烧放出的热量 | |
| CH4 | 2.75g | 56kJ |
| C | 3.67g | 32kJ |
6.下列物质属于氧化物的一组是( )
| A. | 大理石、水 | B. | 干冰、四氧化三铁 | C. | 空气、天然气 | D. | 一氧化碳、酒精 |
 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.