题目内容
14.探究性学习小组选择“过氧化氢(H2O2)生成氧气(O2)的快慢与什么因素(如催化剂的种类、反应物的浓度和温度等)有关”的课题进行探究,以下是他们探究的主要过程:[假设]过氧化氢生成氧气的快慢与催化剂种类有关.
[实验方案]常温下,在两瓶相同体积的过氧化氢溶液中分别加入相同质量二氧化锰(MnO2)和CuO,测定各生成一瓶相同体积O2所需要的时间或测定相同时间内收集氧气的体积.
[实验记录]
| 实验编号 | 1 | 2 |
| 反应物 | 6%H2O2 | 6%H2O2 |
| 催化剂 | 1gCuO | 1gMnO2 |
| 收集等体积氧气的时间 | 152s | 38s |
[反思]过氧化氢在常温下分解缓慢,加入二氧化锰或氧化铜后反应明显加快,若要证明二氧化锰和氧化铜是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否改变、
过氧化氢生成的快慢还与哪些因素有关?请你帮助他们继续探究.(只要求提出假设和实验方案)
[假设]H2O2生成O2的快慢与H2O2的质量分数有关
[实验方案]在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量收集相同体积的气体所需的时间.
分析 [实验方案]要比较反应的速率,可以比较产生相同量的产物所需要的时间或相同时间产生产物的量等;
[结论]根据表中提供的数据可以进行相关方面的判断;
[反思]根据催化剂的定义进行反思;
[假设]可以联系反应物的浓度对反应速率的影响,利用控制变量法来进行设计实验.
[实验方案]根据作出的假设采用控制变量法来进行设计实验进行验证.
解答 解:[实验方案]常温下,在两瓶相同体积的过氧化氢溶液中分别加入相同质量二氧化锰(MnO2)和CuO,测定各生成一瓶相同体积O2所需要的时间或测定相同时间内收集氧气的体积等;故填:相同时间内收集氧气的体积;
[结论]根据控制变量法,分析表中的有关数据,可知分别用1gCuO和1gMnO2做催化剂,来催化反应时所用的时间分别是152s和38s;由此可知,用1gMnO2做催化剂要比用1gCuO做催化剂时,化学反应速率要快.因此,由实验现象可以得出的实验结论是:H2O2生成氧气的快慢与催化剂种类有关.故填:H2O2生成氧气的快慢与催化剂种类有关;
[反思]根据催化剂的概念可知,催化剂能改变化学反应的速率,而本身的质量和化学性质在反应前后不改变.故填:质量;化学性质;
[假设]
可以假设:H2O2生成氧气的快慢与过氧化氢的浓度有关.故填:H2O2生成O2的快慢与H2O2的质量分数有关.
[实验方案]在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量收集相同体积的气体所需的时间,从而得出结论.故填:在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量收集相同体积的气体所需的时间.
点评 本题主要考查了收集气体的方法、催化剂的催化作用及其正确设计实验方案等方面的内容.可以依据题干提供的信息结合已有的知识进行.

(1)某同学用托盘天平称取氯化钠固体19g,用量筒量取蒸馏水76mL(水的密度为1g/cm3),配制一定溶质质量分数的氯化钠溶液,该氯化钠溶液的溶质质量分数为20%;
下列实验操作与目的分析均正确的一组是D(填字母序号).
| 项目 | 实验操作 | 目的分析 |
| A | 称取氯化钠时,将取出的过量氯化钠放回原瓶 | 节约药品 |
| B | 溶解氯化钠时用玻璃棒搅拌 | 增强氯化钠的溶解能力 |
| C | 称取氯化钠时,在天平两边托盘上各放一张质量相等的纸 | 整洁美观 |
| D | 最取所需水时,视线与量筒内液体凹液面的最低处保持水平 | 准确读数 |
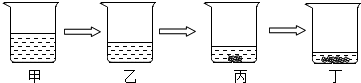
(3)实验室若用恒温蒸发的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示.与丙烧杯中溶液溶质质量分数一定相同的是丁烧杯中的溶液.
(1)H2O2的相对分子质量是34;
(2)H2O2中氢元素与氧元素的质量比为1:16.
| A. | ①③⑤ | B. | ②④ | C. | ②③⑤ | D. | ③④⑤ |
| A. | 氯酸钾加热后固体越来越少 | |
| B. | 打开盛装酒精的瓶盖,酒精的质量会变小 | |
| C. | 澄清石灰水露置在空气中变重 | |
| D. | 镁带燃烧后,固体物质的质量会增加 |