题目内容
5.(1)将混有少量氧化铜的铁粉放入烧杯中,加入过量的盐酸使其充分反应.反应停止后,烧杯中还有少量的固体物质存在,请推断,该固体物质中一定有铜;(2)如果要将混有少量铁粉的氧化铜互相分离,请说出一种简单的方法利用磁铁将铁粉吸附分离.
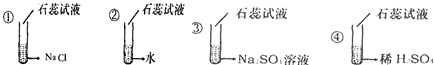
(3)已知硫酸溶液中存在H+、SO42-和H2O,为了证明能使石蕊试液变红的是硫酸溶液中的H+,某同学设计如图所示实验,其中能证明使石蕊试液变红的是硫酸溶液中的H+的实验组合是②③④.
分析 (1)根据金属的活动性铁>氢>铜,混有少量氧化铜的铁粉加入过量稀硫酸充分反应,氧化铜与硫酸反应生成硫酸铜和水,而铁与硫酸及生成的硫酸铜都能发生反应,与硫酸反应生成硫酸亚铁和氢气、与硫酸铜反应生成铜和硫酸亚铁,置换出的铜不能与稀硫酸发生反应.根据以上分析,可对烧杯中的固体物质及溶液中溶质做出判断.
(2)根据铁能被磁铁吸引分析回答;
(3)题目的要求是证明能使石蕊试液变红色的是H+.而要证明这个结论,就要把硫酸中其余的粒子使石蕊变色的可能性排除.题目又说已知硫酸中含有H2O、H+、SO42-,所以就要分别排除H2O和SO42-的作用.
解答 解:(1)由于氧化铜、铁粉都能与稀硫酸反应而稀硫酸过量,烧杯中少量固体物质一定不可能是铁或氧化铜;由于铁能置换出氧化铜与硫酸反应生成的硫酸铜中的铜,而置换出的铜不能与稀硫酸发生反应,则少量固体物质应为铜,稀硫酸过量,铁粉一定被完全反应,没有剩余;
(2)由于铁能被磁铁吸引,所以,如果要将混有少量铁粉的氧化铜互相分离,可利用磁铁将铁粉吸附分离;
(3)由图示可知,实验②不变色,说明水分子不能使石蕊变红;实验③不变色,说明硫酸根离子和水分子不能使石蕊变色;实验④变红,则能使石蕊试液变红色的是H+.所以能证明使石蕊试液变红的是硫酸溶液中的H+的实验组合是②③④.
故答案为:(1)铜;(2)用磁铁将铁粉吸附分离;(3)②③④.
点评 本题考查了实验验证的实验方案设计和性质验证,题目难度较大.

练习册系列答案
相关题目
10.化学变化中往往伴随着气体、沉淀的生成或颜色的变化等现象,我们可以利用现象来鉴别参加反应的物质.下列四种试剂中,能一次就能将澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液区别开来的是( )
| A. | 紫色石蕊试液 | B. | 二氧化碳气体 | C. | 碳酸钠溶液 | D. | 氯化钡溶液 |
17.下列电离方程式书写正确的是( )
| A. | H2SO4═H++SO42- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Cu(NO3)2═Cu2++2NO3- | D. | CaCl2═Ca2++Cl2- |
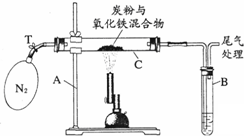 某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下: