题目内容
16.重庆某中学的化学实验小组为了测定纯碱样品(含有少量NaCl)中Na2CO3的质量分数,进行了相关的实验.(1)取少量样品于烧杯中,用水充分溶解,并加入硝酸银溶液,发现有白色沉淀产生,证明:样品不纯净.甲同学查阅资料得知:Ag2CO3是白色沉淀,不溶于水但易溶于硝酸. 他提出还应该再向溶液中加入适量的稀硝酸溶液,并观察到有气泡生成现象时,才能证明样品不纯净.
(2)乙同学取一定量的样品配成溶液,向溶液中加入一定量的CaCl2溶液,将所得沉淀经过洗涤、烘干并称量,计算出了纯碱样品中Na2CO3的质量分数.
为了确定乙同学的实验结果是否准确,丙同学对反应后的溶液作了如下探究:
【实验目的】反应后溶液中溶质成分是什么?
【提出猜想】
①NaCl
②NaCl和CaCl2
③NaCl和Na2CO3
④NaCl、CaCl2和Na2CO3
丙同学经过思考,认为猜想④(填序号)一定不成立.
【实验操作及现象】向反应后溶液中加入适量稀盐酸,有气泡产生.
【实验结论】猜想③成立,说明乙同学的实验结论不准确,实验所得数值比实际数值偏小(填“偏小”或“偏大”).
分析 (1)氯化钠和碳酸钠都能与硝酸银反应分别生成了氯化银和碳酸银沉淀,碳酸银沉淀能溶于稀硝酸,据此分析回答;
(2)【提出猜想】根据碳酸钠与氯化钙的反应及反应物的量进行猜想;
【实验操作及现象】碳酸钠能与盐酸反应生成了二氧化碳气体.
【实验结论】反应的溶液中含有碳酸钠,说明了碳酸钠没有完全反应,据此分析对计算结果的影响.
解答 解:(1)由于碳酸钠能与硝酸银反应生成了碳酸银沉淀,碳酸银能与稀硝酸反应生成了气体.所以,应该再向溶液中加入适量的稀硝酸溶液,并观察到有气泡生成现象时,才能证明样品不纯净.
(2)【提出猜想】由于碳酸钠与氯化钙的反应生成了碳酸钙沉淀和氯化钠,由反应物质的量不同,反应后的溶液的溶质不同,当碳酸钠过量时有剩余的,所以,猜想③是NaCl和Na2CO3;
由于氯化钙能与碳酸钠反应生成了沉淀,所以猜想④错误
【实验操作及现象】向反应后溶液中加入适量稀盐酸,有气泡产生,说明了含有碳酸钠,说明了含有碳酸钠.
【实验结论】反应的溶液中含有碳酸钠,说明了碳酸钠没有完全反应.实验所得数值比实际数值偏小.
故答为:(1)稀硝酸,有气泡生成.
(2)【提出猜想】由Na2CO3;④;
【实验操作及现象】气泡.
【实验结论】偏小.
点评 本题通过实验探究了碳酸钠的存在、含量等.难度不大,掌握碳酸根离子的检验方法是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.“化学反应条件的控制是实验的灵魂”.某探究小组为探究影响过氧化氢溶液分解速率快慢的因素,在不同条件下进行了四次实验探究,记录数据如下表:
请你分析上表数据回答下列问题:
(1)从①②数据分析,过氧化氢溶液分解速率快慢与何因素有关?
(2)从③④数据分析,影响因素与过氧化氢溶液分解速率的关系.
| 实验 序号 | 过氧化氢 的质量分数 | 过氧化氢 溶液体积(mL) | 温度 | 二氧化锰 的用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
| ① | 5% | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15% | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30% | 5 | 35 | 2 | 49.21 | |
| ④ | 30% | 5 | 55 | 2 | 10.76 |
(1)从①②数据分析,过氧化氢溶液分解速率快慢与何因素有关?
(2)从③④数据分析,影响因素与过氧化氢溶液分解速率的关系.
4. 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
[实验一]选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
[实验二]选择合适的反应温度
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
请根据本次活动的研究目的,分析处理以上两个表中数据,得出结论:
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为25%;在合适的硫酸浓度下,应选择最合适的反应温度为70℃.在最合适反应温度时硫酸与大理石反应的化学方程式为CaCO3+H2SO4═CaSO4+CO2↑+H2O.
(2)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加摇动试管(或摇动装置)操作,更有利于气体的制备.
(3)你认为该研究小组还可以研究碳酸钙固体颗粒大小(其它合理回答也给分,例如“大理石纯度”等)对该反应速率的影响.
(4)在如图硫酸和大理石反应的装置中,最佳选用丙(填编号).
 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.[实验一]选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为25%;在合适的硫酸浓度下,应选择最合适的反应温度为70℃.在最合适反应温度时硫酸与大理石反应的化学方程式为CaCO3+H2SO4═CaSO4+CO2↑+H2O.
(2)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加摇动试管(或摇动装置)操作,更有利于气体的制备.
(3)你认为该研究小组还可以研究碳酸钙固体颗粒大小(其它合理回答也给分,例如“大理石纯度”等)对该反应速率的影响.
(4)在如图硫酸和大理石反应的装置中,最佳选用丙(填编号).
1.如图是某化学反应的微观模型,“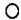 ”、“
”、“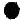 ”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
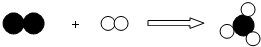
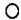 ”、“
”、“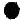 ”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )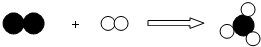
| A. | 该反应属于分解反应 | |
| B. | 反应中共有三种元素参与 | |
| C. | 反应物和生成物中只有一种单质 | |
| D. | 参加反应的两种物质分子个数之比为1:3 |
8.柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是制备一水柠檬酸晶体(C6H8O7.H2O)的工艺流程图.回答相关问题:
【资料卡片】
①柠檬酸水溶液显酸性.
②工业生产柠檬酸,原料预处理后,得到的发酵液中含有柠檬酸及其他可溶性杂质.
③一水柠檬酸在不同温度下的溶解度如表:
【钙盐法制备】
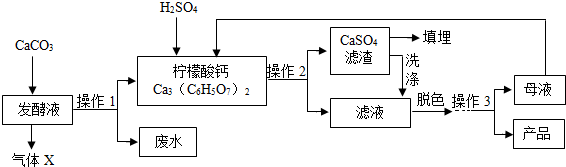
(1)气体X是CO2(填化学式),实验室检验该气体的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
(2)在发酵液中加入CaCO3,同时升温至90℃,这样做的目的是使反应更充分进行.
(3)加入硫酸反应的化学方程式为3H2SO4+Ca3(C6H5O7)2=3CaSO4↓+2C6H8O7,是复分解反应(填基本反应类型).
(4)操作1、2的名称是过滤,实验室完成此操作,所需要的玻璃仪器有ac(填字母)及玻璃棒.

(5)操作3的目的是得到一水柠檬酸晶体,操作顺序是b→a→a.
a过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(6)工业生产中,可加入活性炭(填名称)进行脱色处理.
(7)洗涤CaSO4滤渣的目的是将CaSO4表面附着的柠檬酸充分利用,提高产率.
(8)母液可以循环使用,其中一定含有的溶质是柠檬酸、硫酸钙.
【资料卡片】
①柠檬酸水溶液显酸性.
②工业生产柠檬酸,原料预处理后,得到的发酵液中含有柠檬酸及其他可溶性杂质.
③一水柠檬酸在不同温度下的溶解度如表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |

(1)气体X是CO2(填化学式),实验室检验该气体的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
(2)在发酵液中加入CaCO3,同时升温至90℃,这样做的目的是使反应更充分进行.
(3)加入硫酸反应的化学方程式为3H2SO4+Ca3(C6H5O7)2=3CaSO4↓+2C6H8O7,是复分解反应(填基本反应类型).
(4)操作1、2的名称是过滤,实验室完成此操作,所需要的玻璃仪器有ac(填字母)及玻璃棒.

(5)操作3的目的是得到一水柠檬酸晶体,操作顺序是b→a→a.
a过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(6)工业生产中,可加入活性炭(填名称)进行脱色处理.
(7)洗涤CaSO4滤渣的目的是将CaSO4表面附着的柠檬酸充分利用,提高产率.
(8)母液可以循环使用,其中一定含有的溶质是柠檬酸、硫酸钙.
5.在日常生活中,下列做法正确的是( )
| A. | 用工业盐亚硝酸钠烹调食物 | |
| B. | 用煮沸的方法降低水的硬度 | |
| C. | 室内起火时,立即打开所有门窗进行呼救 | |
| D. | 冬天在室内用炭烤火取暖时,关闭门窗 |
6.诗词谚语中蕴含着一定的科学道理.下列说法正确的是( )
| A. | “春蚕到死丝方尽,蜡炬成灰泪始干”既涉及物理变化又涉及化学变化 | |
| B. | “众人拾柴火焰高”是指可燃物越多,着火点越低,越容易着火 | |
| C. | “百炼成钢”与“只要功夫深,铁杵磨成针”蕴含的化学原理相同 | |
| D. | “真金不怕火炼”是说黄金熔点很高 |