题目内容
17.实验室用H2O2溶液和MnO2固体混合制取O2,回答下列问题:
(1)小明设计了如图所示的制取装置,发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,装置中用注射器代替长颈漏斗的优点是可控制反应速率(答出一点即可)
(2)同组的小刚想从反应后的混合物中分离出MnO2固体,其主要操作是过滤,此操作中必须用到的玻璃仪器是漏斗、烧杯和玻璃棒
(3)实验室还可以利用上述装置,以氯酸钾为原料制备氧气,反应如下:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,请你简述从该反应后的固体剩余物中回收MnO2的主要操作步骤:溶解、过滤、洗涤、干燥.
分析 (1)写出利用固体与液体反应不需要加热的发生装置制取氧气的反应原理的化学方程式;对比长颈漏斗与注射器的不同作用,说明替代后的优点;
(2)反应后的混合合为水与二氧化锰形成的固体与液体的混合物,从液体中分离固体可采取过滤操作;过滤中需要使用的仪器有铁架台、漏斗、烧杯、玻璃棒.
(3)回收MnO2的主要操作步骤是溶解、过滤、洗涤、干燥.
解答 解:(1)制取装置适用于固体与液体发生反应且不需要加热,因此使用该装置制取氧气时,应选取过氧化氢在二氧化锰催化下分解的反应,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;该装置把不能控制加入液体用量与速度的长颈漏斗改成注射器,使得液体药品的加入可以随意控制;
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;可控制反应速率;
(2)过氧化氢分解生成水和氧气,催化剂二氧化锰反应前后不变,因此反应后的混合物为二氧化锰和水形成,此时可通过过滤的方法分离出固体二氧化锰;进行过滤时需要使用的玻璃仪器有:漏斗、烧杯和玻璃棒;
故答案为:过滤;漏斗、烧杯和玻璃棒
(3)以氯酸钾为原料制备氧气时,反应后的固体剩余物中回收MnO2的主要操作步骤是溶解、过滤、洗涤、干燥.因反应剩余物中的KCl可溶于水,可以用溶解、过滤除去,然后洗涤、干燥得到MnO2.
故答案为:溶解、过滤、洗涤、干燥
点评 制取气体的发生装置根据所使用药品的状态及反应条件可分为:固体加热型和固体与液体反应不需要加热型两种.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
12.下列对用排水法收集满氧气的集气瓶的处理方法中,正确的是( )
| A. | 将集气瓶从水中提起后,用玻璃片盖住瓶口,然后使瓶口向上正立放在桌面上 | |
| B. | 在水下用玻璃片盖住集气瓶口后一起拿出水面,然后正立放置在桌面上 | |
| C. | 将集气瓶从水中提出后倒立放置在桌面上 | |
| D. | 将集气瓶仍然留在水槽中,用时再取出来 |
2.下列现象中,没有发生化学变化的是( )
| A. | 敞口放置的澄清石灰水中有白色固体析出 | |
| B. | 敞口放置的氯化钠饱和溶液中有白色固体析出 | |
| C. | 浓硫酸溅到木材上,木材变黑色斑点 | |
| D. | 长期掩埋于地下的铁器上产生红褐色物质 |
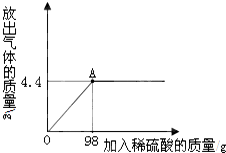 某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示,请根据题意解答问题:
某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示,请根据题意解答问题: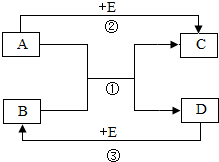 A~E均是初中化学常见的物质,它们的相互转化关系如图所示(反应条件、部分反应物和生成物已略去)
A~E均是初中化学常见的物质,它们的相互转化关系如图所示(反应条件、部分反应物和生成物已略去)